การศึกษาประสิทธิภาพและความปลอดภัยของอีโลบิซิแบตต่อภาวะท้องผูกในผู้ป่วยโรคไตเรื้อรังระยะสุดท้ายที่ได้รับการรักษาด้วยการฟอกเลือดด้วยเครื่องไตเทียม: การศึกษาแบบสุ่มและมีกลุ่มควบคุม
Main Article Content
บทคัดย่อ
บทนำ: ภาวะท้องผูกเรื้อรังเป็นภาวะที่พบได้บ่อยในผู้ป่วยโรคไตเรื้อรังระยะสุดท้าย ยาอีโลบิซิแบตเป็นยาระบายชนิดใหม่ที่ออกฤทธิ์ยับยั้งการดูดซึมกรดน้ำดีที่ลำไส้ และถูกนำมาใช้ในการรักษาภาวะท้องผูกเรื้อรังโดยจะไปช่วยกระตุ้นการทำงานของลำไส้ อย่างไรก็ตามยังไม่มีการศึกษาประสิทธิภาพและความปลอดภัยของยากลุ่มนี้ในผู้ป่วยโรคไตเรื้อรังระยะสุดท้ายที่ได้รับการฟอกเลือดด้วยเครื่องไตเทียม
ระเบียบวิธีวิจัย: การศึกษาแบบสุ่มและมีกลุ่มควบคุมในผู้ป่วยที่ได้รับการฟอกเลือดด้วยเครื่องไตเทียมที่มีภาวะท้องผูกเรื้อรังโดยวินิจฉัยตามเกณฑ์ Rome IV ผู้ป่วยถูกจัดเข้าสู่กลุ่มอีโลบิซิแบตหรือยาหลอกแบบสุ่มในอัตราส่วน 1:1 เป็นระยะเวลานาน 12 สัปดาห์ มีการประเมินการเปลี่ยนแปลงของ Bristol stool form scale (BSFS), จำนวนครั้งของการถ่ายอุจจาระ และ จำนวนครั้งของการถ่ายอุจจาระที่รู้สึกถ่ายสุดต่อสัปดาห์, ระดับ LDL cholesterol และ P-cresol ก่อนและหลังจากได้รับการรักษาไปแล้ว 12 สัปดาห์
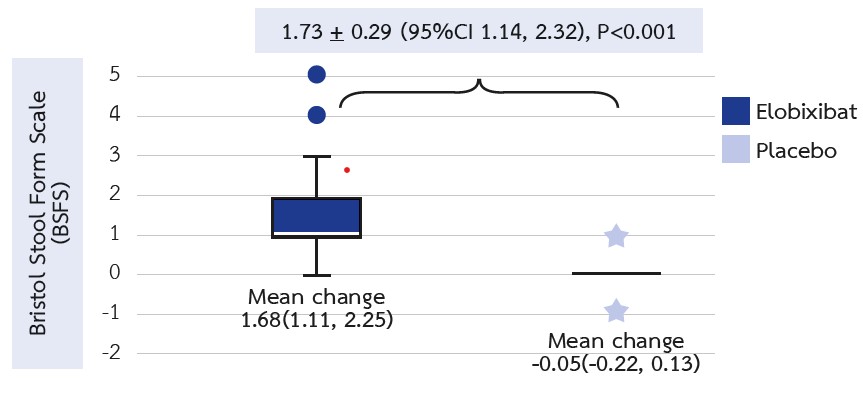
ผลการศึกษา: มีผู้ป่วยเข้าร่วมการศึกษาทั้งหมด 46 ราย หลังจากได้ยาที่ 12 สัปดาห์พบว่ากลุ่มอีโลบิซิแบตมี BSFS ดีขึ้นมากกว่ากลุ่มยาหลอกอย่างมีนัยสำคัญทางสถิติ (mean difference (95% confidence interval) =1.93 (1.37, 2.48), P<0.001) มีการเพิ่มขึ้นของจำนวนครั้งของการถ่ายอุจจาระ (2.46 (1.69, 3.23), P<0.001) และจำนวนครั้งของการถ่ายอุจจาระที่รู้สึกว่าถ่ายสุดต่อสัปดาห์ (2.83 (1.63, 3.39), P<0.001) ในกลุ่มที่ได้รับอิโลบิซิแบตอย่างมีนัยสำคัญทางสถิติ นอกจากนี้ยังพบว่ามีการลดลงของระดับ LDL cholesterol เปรียบเทียบกับยาหลอก (-12.41 (-24.72, - 0.09), P<0.001) แต่ไม่พบความแตกต่างกันของการเปลี่ยนแปลงของระดับ P-cresol และไม่พบผลข้างเคียงของยาที่รุนแรง
สรุป: ยาอีโลบิซิแบตช่วยลดอาการท้องผูกและระดับ LDL cholesterol ในผู้ป่วยที่ได้รับการฟอกเลือดด้วยเครื่องไตเทียม ผลการศึกษานี้แสดงให้เห็นถึงประสิทธิภาพของยาอีโลบิซิแบตในการักษาภาวะท้องผูกเรื้อรัง
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Masakane I, Taniguchi M, Nakai S, Tsuchida K, Wada A, Ogata S, et al. Annual Dialysis Data Report 2016, JSDT Renal Data Registry. Ren Replace Ther. 2018;4(1):45.
Strid H, Simrén M, Johansson AC, Svedlund J, Samuelsson O, Björnsson ES. The prevalence of gastrointestinal symptoms in patients with chronic renal failure is increased and associated with impaired psychological general well-being. Nephrol Dial Transplant. 2002;17(8):1434-9.
Chang JY, Locke GR 3rd, McNally MA, Halder SL, Schleck CD, Zinsmeister AR, et al. Impact of functional gastrointestinal disorders on survival in the community. Am J Gastroenterol. 2010;105(4):822-32.
Honkura K, Tomata Y, Sugiyama K, Kaiho Y, Watanabe T, Zhang S, et al. Defecation frequency and cardiovascular disease mortality in Japan: The Ohsaki cohort study. Atherosclerosis. 2016;246:251-6.
Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol. 1998;9(12 Suppl):S16-23.
Yasuda G, Shibata K, Takizawa T, Ikeda Y, Tokita Y, Umemura S, et al. Prevalence of constipation in continuous ambulatory peritoneal dialysis patients and comparison with hemodialysis patients. Am J Kidney Dis. 2002;39(6):1292-9.
Himmelfarb J. Uremic toxicity, oxidative stress, and hemodialysis as renal replacement therapy. Semin Dial. 2009;22(6):636-43.
Ramezani A, Massy ZA, Meijers B, Evenepoel P, Vanholder R, Raj DS. Role of the Gut Microbiome in Uremia: A Potential Therapeutic Target. Am J Kidney Dis. 2016;67(3):483-98.
Attaluri A, Jackson M, Valestin J, Rao SS. Methanogenic flora is associated with altered colonic transit but not stool characteristics in constipation without IBS. Am J Gastroenterol. 2010;105(6):1407-11.
Quigley EM. The enteric microbiota in the pathogenesis and management of constipation. Best Pract Res Clin Gastroenterol. 2011;25(1):119-26.
Mori H, Tack J, Suzuki H. Magnesium Oxide in Constipation. Nutrients. 2021;13(2):421.
Xing JH, Soffer EE. Adverse effects of laxatives. Dis Colon Rectum. 2001;44(8):1201-9.
Locke GR 3rd, Pemberton JH, Phillips SF. AGA technical review on constipation. American Gastroenterological Association. Gastroenterology. 2000;119(6):1766-78.
Acosta A, Camilleri M. Elobixibat and its potential role in chronic idiopathic constipation. Therap Adv Gastroenterol. 2014;7(4):167-75.
Kamei D, Kamei Y, Nagano M, Mineshima M, Nitta K, Tsuchiya K. Elobixibat alleviates chronic constipation in hemodialysis patients: a questionnaire-based study. BMC Gastroenterol. 2020;20(1):26.
Shono T, Hyakutake H. Efficacy and safety of elobixibat in hemodialysis patients with chronic constipation: a retrospective study. Ren Replace Ther. 2020;6(1):21.
Matsuyama M, Hirai K, Nonaka H, Ueda M, Morino J, Kaneko S, et al. Effects of Elobixibat on Constipation and Lipid Metabolism in Patients With Moderate to End-Stage Chronic Kidney Disease. Front Med (Lausanne). 2022;17:8:780127.
Nakajima A, Seki M, Taniguchi S, Ohta A, Gillberg PG, Mattsson JP, et al. Safety and efficacy of elobixibat for chronic constipation: results from a randomised, double-blind, placebo-controlled, phase 3 trial and an open-label, single-arm, phase 3 trial. Lancet Gastroenterol Hepatol. 2018;3(8):537-47.
Yoshinobu S, Hasuzawa N, Nagayama A, Iwata S, Yasuda J, Tokubuchi R, et al. Effects of Elobixibat, an Inhibitor of Ileal Bile Acid Transporter, on Glucose and Lipid Metabolism: A Single-arm Pilot Study in Patients with T2DM. Clin Ther. 2022;44(10):1418-26.