โรคไตจากออกซาเลต
Main Article Content
บทคัดย่อ
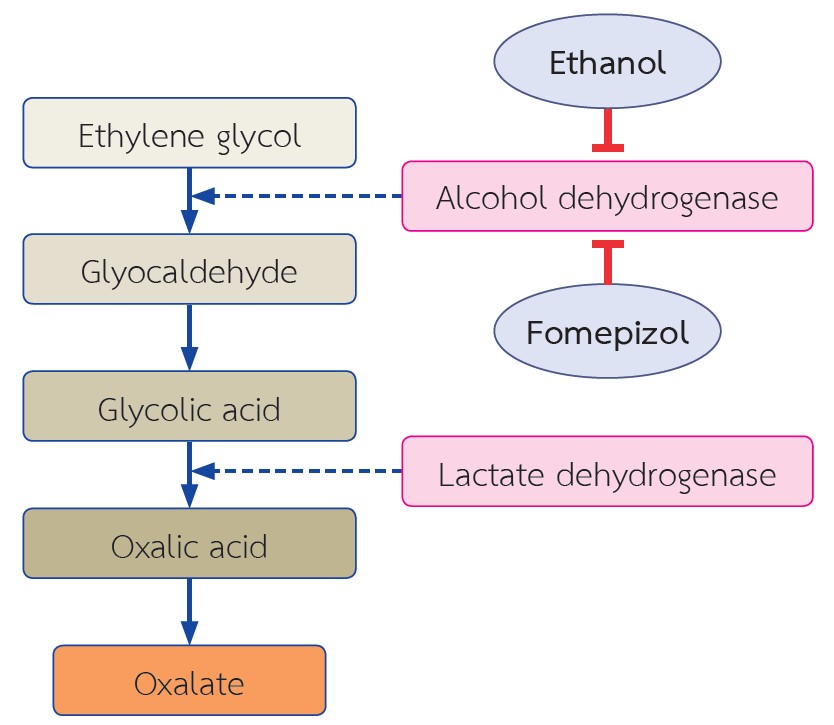
ออกซาเลตเป็นสารที่ไม่ทราบหน้าที่แน่ชัดในร่างกาย ร้อยละ 80 ของออกซาเลตในเลือดได้มาจากการสังเคราะห์ในตับโดยอาศัยเอนไซม์ชนิดต่างๆ ส่วนที่เหลือร้อยละ 20 ได้มาจากการรับประทานอาหาร ปัจจัยที่ส่งผลต่อการดูดซึมออกซาเลตในลำไส้ที่สำคัญ คือ ปริมาณแคลเซียม ปริมาณไขมันในอาหาร และจุลินทรีย์ในลำไส้ ส่วนการขับออกซาเลตออกจากร่างกายอาศัยการขับทางไตออกทางปัสสาวะเป็นหลัก ในกรณีที่มีความผิดปกติของเมแทบอลิซึมของออกซาเลต เช่น โรคทางพันธุกรรมหรือโรคเกี่ยวกับลำไส้ ความเข้มข้นของออกซาเลตในเลือดจะเพิ่มสูงขึ้น ส่งผลให้ร่างกายพยายามขับออกซาเลตออกทางปัสสาวะเพิ่มขึ้น การที่ความเข้มข้นของออกซาเลตในไตสูงขึ้นเป็นระยะเวลานานติดต่อกัน สามารถส่งผลให้เกิดความผิดปกติในไตได้หลายรูปแบบ เช่น โรคไตจากออกซาเลตแบบเฉียบพลันหรือเรื้อรัง โรคนิ่วจากออกซาเลต ซึ่งจะนำไปสู่การเกิดโรคไตเรื้อรังในที่สุด เมื่อไตขับออกออกซาเลตออกจากร่างกายไม่ได้ จึงทำให้เกิดการสะสมของออกซาเลตในอวัยวะต่างๆ เช่น ตา กระดูก และ หัวใจ เป็นต้น การเจาะชิ้นเนื้อไตสามารถพบผลึกออกซาเลตในเนื้อไตและท่อไต ร่วมกับการเสียหายของท่อไตและเนื้อไต การศึกษาที่เกี่ยวข้องกับพยาธิสรีรวิทยาในปัจจุบันเชื่อว่า แคลเซียมออกซาเลตสามารถไปกระตุ้นระบบภูมิคุ้มกันภายในร่างกาย ผ่านตัวรับสัญญาณเอ็นแอลอาร์พีสาม (NLRP3) การรักษาแบ่งเป็นการรักษาแบบจำเพาะเจาะจงที่มีเป้าหมาย เพื่อกำจัดสาเหตุที่ทำให้มีการคั่งของออกซาเลต เช่น การปลูกถ่ายตับและไต การรับประทานเอนไซม์ตับอ่อนเสริมในผู้ป่วยที่ตับอ่อนมีปัญหา ทำให้ไม่สามารถผลิตเอนไซม์ได้ และ การรักษาแบบประคับประคอง ได้แก่ การดื่มน้ำเพิ่มขึ้น การรับประทานยาเม็ดแคลเซียม การรับประทานอาหารที่มีปริมาณออกซาเลตและไขมันต่ำ เป็นต้น หากผู้ป่วยมีความจำเป็นต้องได้รับการบำบัดทดแทนไต ควรพยายามควบคุมระดับของออกซาเลตในเลือดให้ต่ำที่สุด ทั้งนี้เพื่อป้องกันการสะสมของออกซาเลตในอวัยวะอื่นๆ
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Buysschaert B, Aydin S, Morelle J, Gillion V, Jadoul M, Demoulin N. Etiologies, Clinical Features, and Outcome of Oxalate Nephropathy. Kidney Int Rep. 2020;5:1503-9.
Demoulin N, Aydin S, Gillion V, Morelle J, Jadoul M. Pathophysiology and Management of Hyperoxaluria and Oxalate Nephropathy: A Review. American Journal of Kidney Diseases. Forthcoming 2022.
Huang Y, Zhang YH, Chi ZP, Huang R, Huang H, Liu G, et al. The handling of oxalate in the body and the origin of oxalate in calcium oxalate stones. Urologia internationalis. 2020;104:167-76.
Chanapa P. The risk factors of kidney stones focusing on calcium and oxalate. Songklanagarind Medical Journal. 2012;29:299-308.
Ferrara L. Averrhoa carambola Linn: Is it really a toxic fruit? International Journal of Medical Reviews. 2018;5:2-5.
Liu M, Nazzal L. Enteric hyperoxaluria: role of microbiota and antibiotics. Current opinion in nephrology and hypertension. 2019;28:352-9.
Dawson PA, Russell CS, Lee S, McLeay SC, van Dongen JM, Cowley DM, et al. Urolithiasis and hepatotoxicity are linked to the anion transporter Sat1 in mice. The Journal of clinical investigation. 2010;120:706-12.
Beck BB, Hoyer-Kuhn H, Göbel H, Habbig S, Hoppe B. Hyperoxaluria and systemic oxalosis: an update on current therapy and future directions. Expert opinion on investigational drugs. 2013;22:117-29.
Anders H-J, Suarez-Alvarez B, Grigorescu M, Foresto-Neto O, Steiger S, Desai J, et al. The macrophage phenotype and inflammasome component NLRP3 contributes to nephrocalcinosis-related chronic kidney disease independent from IL-1–mediated tissue injury. Kidney international. 2018;93:656-69.
Glew RH, Sun Y, Horowitz BL, Konstantinov KN, Barry M, Fair JR, et al. Nephropathy in dietary hyperoxaluria: A potentially preventable acute or chronic kidney disease. World journal of nephrology. 2014;3:122.
Geraghty R, Wood K, Sayer J. Calcium oxalate crystal deposition in the kidney: identification, causes and consequences. Urolithiasis. 2020;48:1-8.
Mulay SR, Anders H-J. Crystallopathies. New England Journal of Medicine. 2016;374:2465-76.
Ermer T, Eckardt K-U, Aronson PS, Knauf F. Oxalate, inflammasome, and progression of kidney disease. Current opinion in nephrology and hypertension. 2016;25:363.
Fogo AB, Lusco MA, Najafian B, Alpers CE. AJKD atlas of renal pathology: oxalosis. American Journal of Kidney Diseases. 2017;69:e13-e4.
Bhasin B, Ürekli HM, Atta MG. Primary and secondary hyperoxaluria: Understanding the enigma. World journal of nephrology. 2015;4:235.
Milliner DS, Harris PC, Cogal AG, Lieske JC. Primary hyperoxaluria type 1. 2017;25:1-37.
Coulter-Mackie MB, White CT, Hurley RM, Chew BH, Lange D. Primary hyperoxaluria type 1. Gene ReviewsTM [Internet]. In: Pagon RA, Ardinger HH. Adam MP, Bird TD, Dolan CR, Fong CT, Stephens K, editors. Seattle (Washington):University of Washington, 1993-2013.
Monico CG, Persson M, Ford GC, Rumsby G, Milliner DS. Potential mechanisms of marked hyperoxaluria not due to primary hyperoxaluria I or II. Kidney international. 2002;62:392-400.
Ramaswamy C, Williams J, Griffiths D. Reversible acute renal failure with calcium oxalate cast nephropathy—possible role of ascorbic acid. Nephrology Dialysis Transplantation. 1993;8:1387-9.
Parry MF, Wallach R. Ethylene glycol poisoning. The American journal of medicine. 1974;57:143-50.
Frascino JA, Vanamee P, Rosen PP. Renal oxalosis and azotemia after methoxyflurane anesthesia. New England Journal of Medicine. 1970;283:676-9.
Cochat P, Rumsby G. Primary hyperoxaluria. New England Journal of Medicine. 2013;369:649-58.
Rosenstock JL, Joab TM, DeVita MV, Yang Y, Sharma PD, Bijol V. Oxalate nephropathy: a review. Clinical Kidney Journal. 2021;14:1859-993.