การศึกษาแบบนำร่องของโมเลกุลการยึดเกาะของเซลล์บุผนังหลอดเลือดในการทำนายการเจริญเติบโตของเส้นฟอกเลือดแท้
Main Article Content
บทคัดย่อ
บทนำ: การทำนายการเจริญเติบโตของเส้นฟอกเลือดแท้ (arteriovenous fistula) ในผู้ป่วยโรคไตเรื้อรังระยะสุดท้าย ยังเป็นไปได้ยากและปัจจัยที่นำมาใช้ในการทำนายยังขาดความแม่นยำ โมเลกุลการยึดเกาะของเซลล์บุผนังหลอดเลือด (Soluble Vascular Cell Adhesion Molecule หรือ sVCAM) เป็นตัวชี้วัดการทำงานของหลอดเลือด แต่ปัจจุบันยังไม่มีข้อมูลในการทำนายความสมบูรณ์ของเส้นฟอกเลือดแท้ งานวิจัยนี้มีวัตถุประสงค์เพื่อประเมินความสามารถของระดับ sVCAM ในการทำนายความสมบูรณ์ของเส้นฟอกเลือดแท้ที่ 8 สัปดาห์ภายหลังการผ่าตัด
ระเบียบและวิธีวิจัย: การศึกษาเชิงวินิจฉัยแบบไปข้างหน้าในผู้ป่วย 19 รายที่เข้ารับการผ่าตัดทำเส้นฟอกเลือดใน โดยตรวจวัดระดับ sVCAM ก่อนการผ่าตัด และหลังผ่าตัด 4 สัปดาห์ โดยประเมินความสมบูรณ์ของ เส้นฟอกเลือดที่ 8 สัปดาห์โดยใช้อัลตราซาวด์
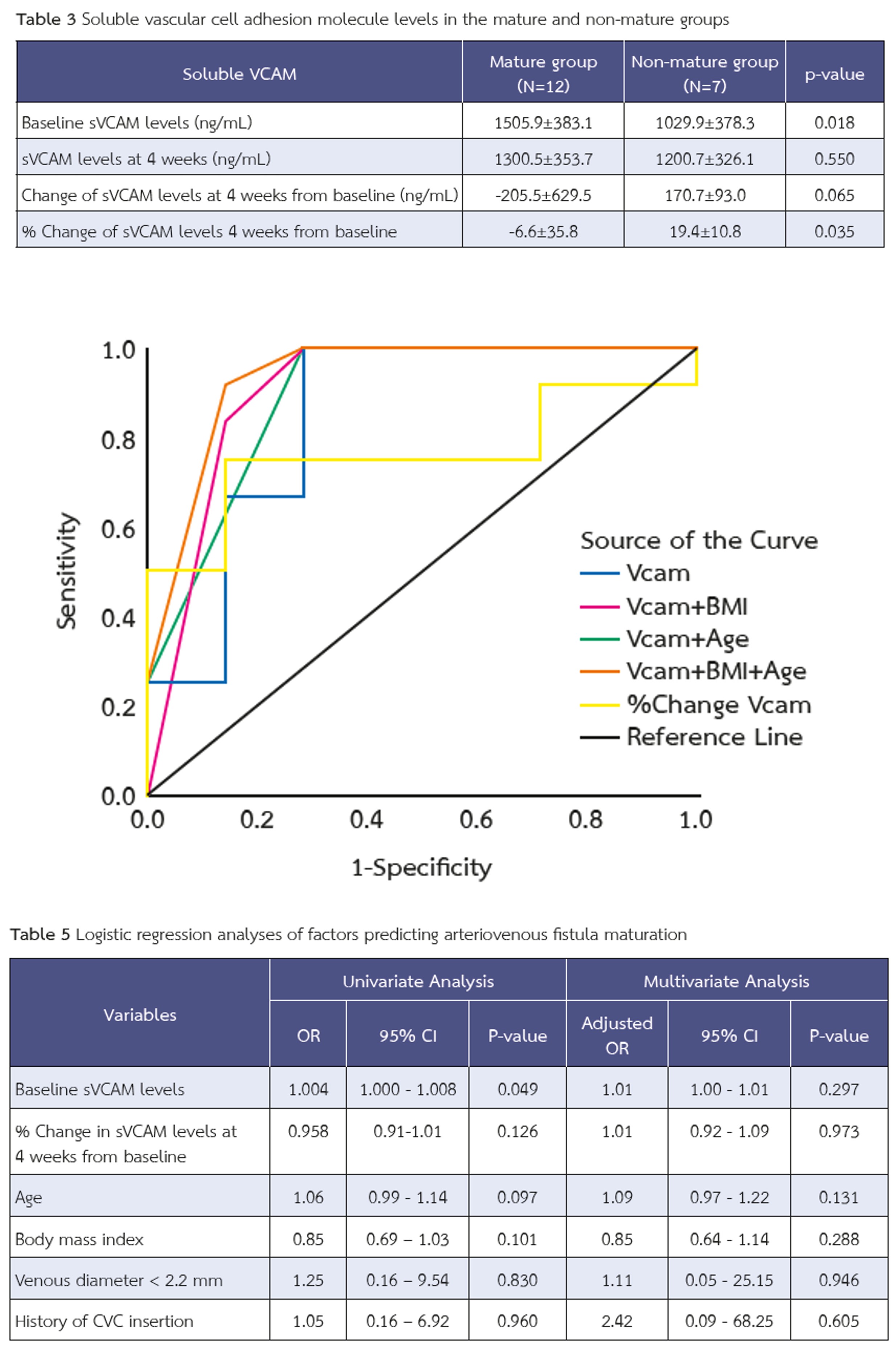
ผลการวิจัย: พบผู้ป่วย 12 รายมีเส้นฟอกเลือดที่เติบโต (63%) ในผู้ป่วยที่มีเส้นฟอกเลือดเติบโตมีระดับ sVCAM ก่อนผ่าตัดสูงกว่าผู้ที่มีเส้นฟอกเลือดไม่เติบโตอย่างมีนัยสำคัญ (1505.9±383.1 vs. 1029.9±378.3 นาโนกรัม/มล., p=0.018) และพบการเปลี่ยนแปลงของระดับ sVCAM ที่ 4 สัปดาห์เปรียบเทียบกับก่อนการผ่าตัด แตกต่างกันอย่างมีนัยสำคัญระหว่างทั้งสองกลุ่ม (-6.6±35.8% vs. +19.4±10.8%, p=0.035) โดยค่าระดับ sVCAM ก่อนผ่าตัด ≥985.9 นาโนกรัม/มล. ให้ความไวร้อยละ 100 และความจำเพาะร้อยละ 71.4 ในการทำนายการเจริญเติบโตของเส้นฟอกเลือด โดยมีค่า AUC ที่ 0.845 (95% CI 0.632-1.000) การนำปัจจัยทางคลินิกอื่น ได้แก่ อายุ <73 ปี และ ดัชนีมวลกาย <30 กก./ม.² มาร่วมในโมเดลจะช่วยเพิ่มประสิทธิภาพการทำนายได้ดียิ่งขึ้นโดยมีค่า AUC สูงถึง 0.935 (95% CI 0.804-1.000)
สรุป: ระดับ sVCAM ก่อนการผ่าตัดเป็นตัวบ่งชี้ทางชีวภาพที่มีศักยภาพในการทำนายความสำเร็จของการเจริญเติบโตของเส้นฟอกเลือดแท้ การผสมผสานค่าพารามิเตอร์ทางคลินิกร่วมกับ sVCAM จะช่วยเพิ่มความแม่นยำในการทำนายมากยิ่งขึ้น
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Lok CE, Huber TS, Lee T, Shenoy S, Yevzlin AS, Abreo K, et al. KDOQI Clinical Practice Guideline for Vascular Access: 2019 Update. Am J Kidney Dis. 2020;75(4 Suppl 2):S1-S164. doi: 10.1053/j.ajkd.2019.12.001
González I, Maldonado-Agurto R. The role of cellular senescence in endothelial dysfunction and vascular remodelling in arteriovenous fistula maturation. J Physiol. 2025; 20. doi: 10.1113/jp287387
Garmy-Susini B, Jin H, Zhu Y, Sung R-J, Hwang R, Varner J. Integrin alpha4beta1-VCAM-1-mediated adhesion between endothelial and mural cells is required for blood vessel maturation. J Clin Invest. 2005;115(6):1542-51. doi: 10.1172/jci23445
Kanwar YS. Functional duality of progenitor cells influxing into arterio-venous fistula during its neoangiogenesis. Am J Physiol Renal Physiol. 2007;293(2):F468-9. doi: 10.1152/ajprenal.00237.2007
Saito O, Usui M, Abe M, Okada K, Takei T, Ito Y, Nagata M. Serum endothelial injury markers in hemodialysis patients with arteriovenous fistula stenosis. Jichi Medical University Journal. 2012;35:1-6.
Cai W, Zhu L, Chen X, Chen J, Su S, Li J, et al. Association of advanced glycoxidation end products and inflammation markers with thrombosis of arteriovenous grafts in hemodialysis patients. Am J Nephrol. 2006;26(2):181-5. doi: 10.1159/000093122
Beathard GA, Lok CE, Glickman MH, Al-Jaishi AA, Bednarski D, Cull DL, Lawson JH, Lee TC, Niyyar VD, Syracuse D, Trerotola SO, Roy-Chaudhury P, Shenoy S, Underwood M, Wasse H, Woo K, Yuo TH, Huber TS. Definitions and End Points for Interventional Studies for Arteriovenous Dialysis Access. Clin J Am Soc Nephrol. 2018;13(3):501-12. doi: 10.2215/cjn.11531116
Kitpanit, N. and Makprasert, P. 2021. Maturation Rate of Brachiocephalic VS Brachioantecubital Arteriovenous Fistula; A Prospective Cohort Study. Journal of the Association of General Surgeons of Thailand under the Royal of Patronage of HM the King. 2021; 6 (1):16–23
Martinez LI, Esteve V, Yeste M, Artigas V, Llagostera S. Clinical Utility of a New Predicting Score for Radiocephalic Arteriovenous Fistula Survival. Ann Vasc Surg. 2017;41:56-61. doi: 10.1016/j.avsg.2016.09.022
Siddiqui MA, Ashraff S, Santos D, Rush R, Carline T, Raza Z. Predictive parameters of arteriovenous fistula maturation in patients with end-stage renal disease. Kidney Res Clin Pract. 2018;37(3):277-86. doi: 10.23876/j.krcp.2018.37.3.277
Robbin ML, Chamberlain NE, Lockhart ME, et al. Hemodialysis arteriovenous fistula maturity: US evaluation. Radiology. 2002;225:59–64. doi: 10.1148/radiol.2251011367
Akoglu H. User’s guide to sample size estimation in diagnostic accuracy studies. Turk J Emerg Med. 2022;22(4):177-85. doi: 10.4103/2452-2473.357348
Wongmahisorn Y. Development and validation of a clinical score to predict 1-year survival of arteriovenous fistula access: a diagnostic study. Ann Surg Treat Res. 2020;98(1):44-50. doi: 10.4174/astr.2020.98.1.44
Yan R, Song A, Zhang C. The Pathological Mechanisms and Therapeutic Molecular Targets in Arteriovenous Fistula Dysfunction. Int J Mol Sci. 2024; 25:9519. doi: 10.3390/ijms25179519
Kaur G, Sharma D, Bisen S, et al. Vascular cell-adhesion molecule 1 (VCAM-1) regulates JunB-mediated IL-8/CXCL1 expression and pathological neovascularization. Commun Biol. 2023; 6:516. doi: 10.1038/s42003-023-04905-z
Giannikouris IE, Spiliopoulos S, Giannakopoulos T, Katsanos K, Passadakis P, Georgiadis G. Evaluation of arteriovenous fistula maturation and early prediction of clinical eligibility, using ultrasound: The Fistula Maturation Evaluation (FAME) Study. J Vasc Access. 2024;26(3):926-36. doi: 10.1177/11297298241255519