แบบจำลองการทำนายทางคลินิกของความเสี่ยง ภาวะโพแทสเซียมต่ำในผู้ป่วยภาวะหัวใจล้มเหลวเฉียบพลัน ที่เข้ารับการรักษาในโรงพยาบาลหลังจากได้รับยาขับปัสสาวะฟูโรซีไมด์
Main Article Content
บทคัดย่อ
บทนำ: ผู้ป่วยโรคหัวใจล้มเหลวเฉียบพลันที่เข้ารับการรักษาในโรงพยาบาลมักได้รับยาฟูโรเซไมด์ ซึ่งอาจนำไปสู่ภาวะโพแทสเซียมในเลือดต่ำ ปัจจัยเสี่ยงที่เกี่ยวข้อง ได้แก่ ขนาดยาขับปัสสาวะและการใช้ยาขับปัสสาวะหลายชนิดร่วมกัน วัตถุประสงค์ของการศึกษานี้คือเพื่อพัฒนาโมเดลทำนายความเสี่ยงภาวะโพแทสเซียมต่ำทางคลินิก เพื่อช่วยในการป้องกันการเกิดภาวะดังกล่าวและภาวะแทรกซ้อนที่เกี่ยวข้อง
ระเบียบวิธีวิจัย: เป็นการศึกษาย้อนหลังในผู้ป่วยที่เข้ารับการรักษาในโรงพยาบาลด้วยภาวะหัวใจล้มเหลวเฉียบพลัน (Acute Decompensated Heart Failure หรือ ADHF) โดยใช้การวิเคราะห์ถดถอยโลจิสติกพหุคูณ (multivariable logistic regression) เพื่อสร้างคะแนน ทำนายความเสี่ยงจากการถ่วงน้ำหนักของตัวแปรทำนายและทำการตรวจสอบความถูกต้องภายใน (internal validation) เพื่อประเมินความน่าเชื่อถือของโมเดล
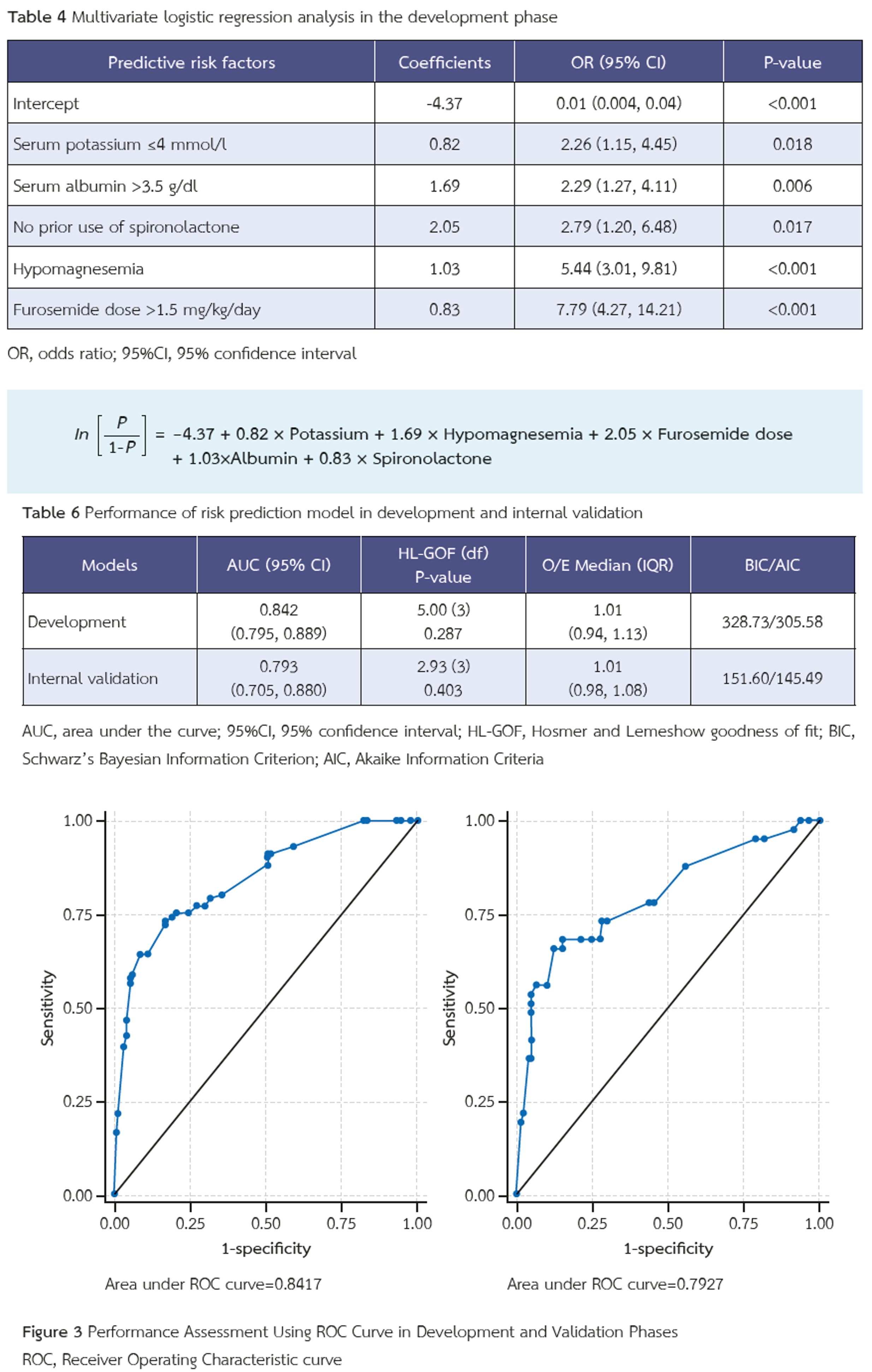
ผลการศึกษา: ในกลุ่มผู้ป่วย ADHF จำนวน 510 รายที่ได้รับฟูโรเซไมด์พบว่ามีผู้ป่วย 143 ราย (28%) ที่เกิดภาวะโพแทสเซียมต่ำ การได้รับฟูโรเซไมด์ในขนาด >1.5 มก./กก./วัน มีความสัมพันธ์อย่างมีนัยสำคัญกับ ภาวะโพแทสเซียมต่ำ (Adjusted OR 4.81, 95% CI 2.56–9.04, p<0.001) โดยพบปัจจัยทำนาย 5 ประการ ได้แก่ ระดับโพแทสเซียมในซีรั่ม <4 มิลลิโมล/ลิตร., ระดับอัลบูมินในซีรั่ม >3.5 กรัม/ดล., ระดับแมกนีเซียมต่ำ, การได้รับฟูโรเซไมด์ >1.5 มก./กก. และการไม่เคยได้รับสไปโรโนแลคโตนมาก่อน คะแนนที่สูงขึ้นสัมพันธ์กับความเสี่ยงในการเกิดภาวะโพแทสเซียมต่ำที่เพิ่มขึ้น
สรุป: โมเดลทำนายทางคลินิกนี้เป็นเครื่องมือที่มีประโยชน์ในการประเมินความเสี่ยงของภาวะโพแทสเซียมต่ำ ผู้ป่วย ADHF ที่ถูกระบุว่ามีความเสี่ยงสูงอาจได้รับประโยชน์จากการป้องกันและการติดตามระดับโพแทสเซียมอย่างใกล้ชิด
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Joseph SM, Cedars AM, Ewald GA, Geltman EM, Mann DL. Acute decompensated heart failure: contemporary medical management. Tex Heart Inst J. 2009;36(6):510-20.
Thu Kyaw M, Maung ZM. Hypokalemia-Induced Arrhythmia: A Case Series and Literature Review. Cureus. 2022;14(3):e22940. doi: 10.7759/cureus.22940
Krogager ML, Søgaard P, Torp-Pedersen C, Bøggild H, Lee CJ, Bonde A, et al. Impact of plasma potassium normalization on short-term mortality in patients with hypertension and hypokalemia or low normal potassium. BMC Cardiovasc Disord. 2020;20(1):386. doi: 10.1186/s12872-020-01654-3
Kim MJ, Valerio C, Knobloch GK. Potassium Disorders: Hypokalemia and Hyperkalemia. Am Fam Physician. 2023;107(1):59-70.
Brueske B, Sidhu MS, Schulman-Marcus J, Kashani KB, Barsness GW, Jentzer JC. Hyperkalemia Is Associated With Increased Mortality Among Unselected Cardiac Intensive Care Unit Patients. J Am Heart Assoc. 2019;8(7):e011814. doi: 10.1161/jaha.118.011814
Lin Z, Wong LYF, Cheung BMY. Diuretic-induced hypokalaemia: an updated review. Postgrad Med J. 2022;98(1160):477-82. doi: 10.1136/postgradmedj-2020-139701
Aimbudlop K, Saengpanit D. Factors Associated with Hypokalemia after Furosemide Treatment in Hospitalized Patients with Acute Decompensated Heart Failure. J Nephrol Soc Thail. 2024;30(1):57-68.
Metcalfe C. Biostatistics: A Foundation for Analysis in the Health Sciences. 7th edn. Wayne W. Daniel, Wiley, 1999. No. of. pages: xiv+755+appendices. ISBN 0-471-16386-4. Statistics in Medicine - STAT MED. 2001;20:324-6. doi: 10.1002/1097-0258(20010130)20:2<324::aid-sim635>3.0.co;2-o
Kapelios CJ, Kaldara E, Ntalianis A, Sousonis V, Repasos E, Sfakianaki T, et al. High furosemide dose has detrimental effects on survival of patients with stable heart failure. Hellenic J Cardiol. 2015;56(2):154-9.
Weiner ID, Wingo CS. Hypokalemia--consequences, causes, and correction. J Am Soc Nephrol. 1997;8(7):1179-88. doi: 10.1681/asn.v871179
Huang CL, Kuo E. Mechanism of hypokalemia in magnesium deficiency. J Am Soc Nephrol. 2007;18(10):2649-52. doi: 10.1681/asn.2007070792
Brater DC. Diuretic therapy. N Engl J Med. 1998;339(6):387-95. doi: 10.1056/nejm199808063390607
Vardeny O, Claggett B, Anand I, Rossignol P, Desai AS, Zannad F, et al. Incidence, predictors, and outcomes related to hypo- and hyperkalemia in patients with severe heart failure treated with a mineralocorticoid receptor antagonist. Circ Heart Fail. 2014;7(4):573-9. doi: 10.1161/circheartfailure.114.001104
Epstein M, Calhoun DA. Aldosterone blockers (mineralocorticoid receptor antagonism) and potassium-sparing diuretics. J Clin Hypertens (Greenwich). 2011;13(9):644-8. doi: 10.1111/j.1751-7176.2011.00511.x
Kieneker LM, Eisenga MF, Joosten MM, de Boer RA, Gansevoort RT, Kootstra-Ros JE, et al. Plasma potassium, diuretic use and risk of developing chronic kidney disease in a predominantly White population. PLoS One. 2017;12(3):e0174686. doi: 10.1371/journal.pone.0174686
Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Jr., Colvin MM, et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017;136(6):e137-e61. doi: 10.1161/cir.0000000000000509