ความชุกและปัจจัยที่สัมพันธ์กับภาวะไตวายเฉียบพลัน หลังการฉีดสารทึบรังสีในโรคไต: การศึกษาแบบย้อนหลัง
Main Article Content
บทคัดย่อ
บทนำ: การศึกษาก่อนหน้านี้พบว่า การฉีดสารทึบรังสีผ่านทางหลอดเลือดในการตรวจเอกซเรย์คอมพิวเตอร์ อาจส่งผลต่อการเกิดภาวะไตวายเฉียบพลันได้ ความชุกและปัจจัยเสี่ยงของภาวะไตวายเฉียบพลันหลังการฉีดสารทึบรังสี (Contrast-Associated Acute Kidney Injury; CA-AKI) มีความแตกต่างกันไปตามลักษณะของประชากร โดยเฉพาะในผู้ป่วยโรคไตเรื้อรัง
ระเบียบวิธีวิจัย: การวิเคราะห์ข้อมูลย้อนหลังในผู้ป่วยที่มีค่าประมาณอัตราการกรองของไตระหว่าง 15 ถึง 59 มล./นาที/1.73 ม ² และได้รับสารทึบรังสีทางหลอดเลือดสำหรับการตรวจเอกซเรย์คอมพิวเตอร์ ตั้งแต่เดือนตุลาคม 2564 ถึง กันยายน 2567 เพื่อศึกษาความชุกและวิเคราะห์ปัจจัยที่เกี่ยวข้องกับการเกิดภาวะ CA-AKI
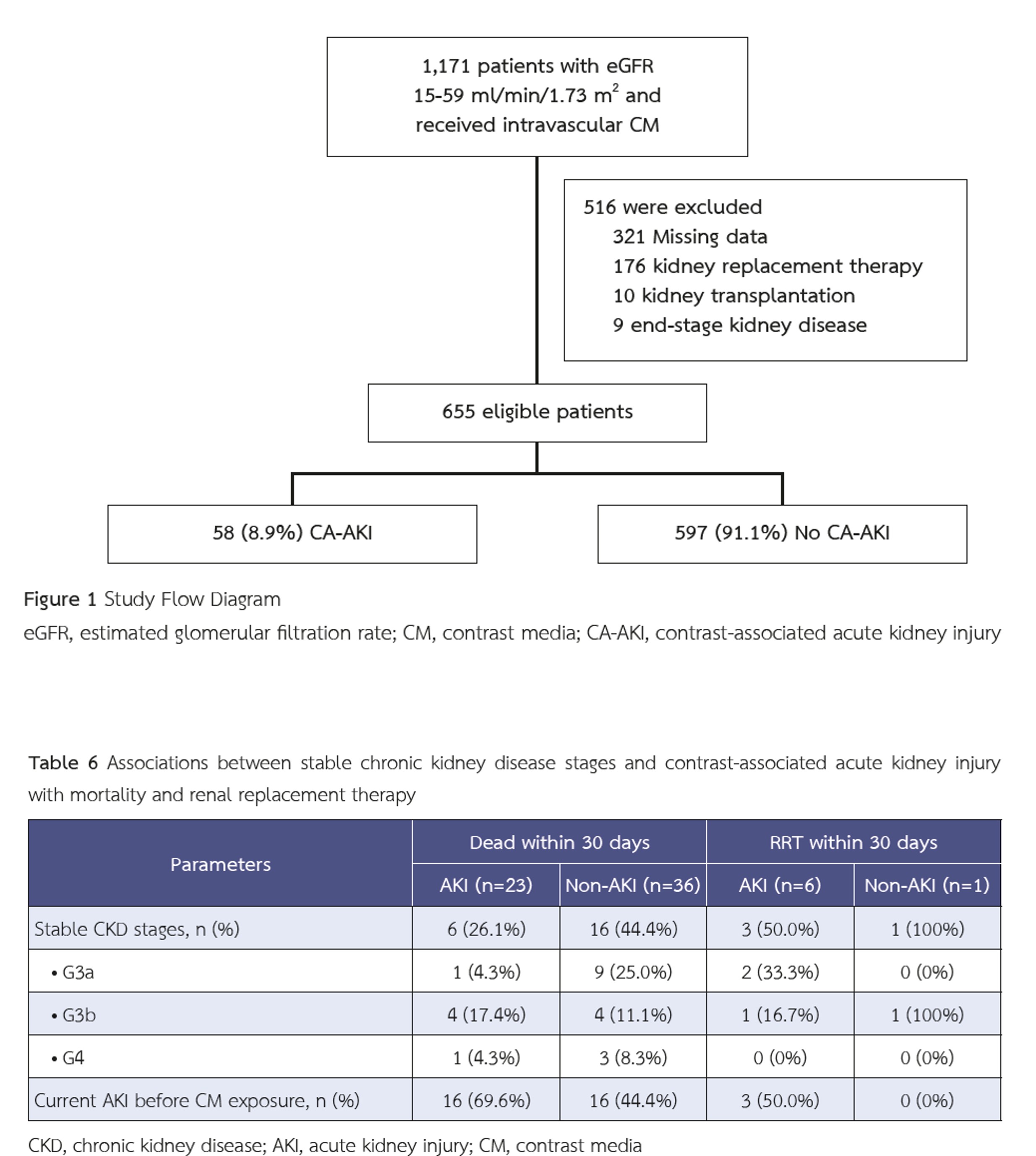
ผลการวิจัย: ผู้ป่วยที่เข้าเกณฑ์ทั้งหมด 655 ราย โดยในจำนวนนี้มีผู้ป่วย 58 ราย (ร้อยละ 8.58) ที่ได้รับการวินิจฉัยว่ามีภาวะ CA-AKI กลุ่มผู้ป่วยที่มีภาวะ CA-AKI มีสัดส่วนของผู้ที่มีโรคไตเรื้อรังระยะ 3b และ 4 การใช้ยาขับปัสสาวะหรือยากระตุ้นความดันโลหิต การได้รับสารทึบรังสีมากกว่าหนึ่งครั้งภายใน 72 ชั่วโมง และการเกิดภาวะไตวายเฉียบพลันขณะได้รับสารทึบรังสี สูงกว่ากลุ่มที่ไม่มีภาวะ CA-AKI ปัจจัยที่มีความสัมพันธ์กับการเกิดภาวะ CA-AKI อย่างมีนัยสำคัญทางสถิติ ได้แก่ โรคไตเรื้อรังระยะ 3b (odds ratio [OR] 2.75; 95% confidence interval [CI], 1.26–6.00; p = 0.011) และภาวะไตวายเฉียบพลันขณะได้รับสารทึบรังสี (OR %95 ;3.99 CI, 8.42–1.89; p < 0.001)
สรุป: ผู้ป่วยที่มีโรคไตเรื้อรังระยะ 3b และผู้ที่เกิดภาวะไตวายเฉียบพลันขณะได้รับสารทึบรังสี มีความเสี่ยงสูงต่อการเกิด CA-AKI ดังนั้นควรให้การป้องกันและติดตามอย่างใกล้ชิด หากจำเป็นต้องได้รับการฉีดสารทึบรังสี
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract 2012;120(4):c179–84. doi: 10.1159/000339789.American college of radiology. ACR manual on contrast media. ACR. 2023:40-6.
American college of radiology. ACR manual on contrast media. ACR. 2023:40-6.
Rachoin JS, Wolfe Y, Patel S, Cerceo E. Contrast associated nephropathy after intravenous administration: what is the magnitude of the problem? Ren Fail 2021;43(1):1311–21. doi: 10.1080/0886022X.2021.1978490.
European society of urogenital radiology. ESUR guidelines on contrast agents. ESUR. 2018:18-20.
Davenport MS, Perazella MA, Yee J, Dillman JR, Fine D, McDonald RJ, et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Radiology 2020;294(3):660–8. doi: 10.1148/radiol.2019192094.
Isaka Y, Hayashi H, Aonuma K, Horio M, Terada Y, Doi K, et al. Guideline on the use of iodinated contrast media in patients with kidney disease 2018. Clin Exp Nephrol 2020;24(1):1–44. doi: 10.1007/s10157-019-01750-5.
Davenport MS, Khalatbari S, Cohan RH, Dillman JR, Myles JD, Ellis JH. Contrast material-induced nephrotoxicity and intravenous low-osmolality iodinated contrast material: risk stratification by using estimated glomerular filtration rate. Radiology 2013;268(3):719–28. doi: 10.1148/radiol.13122276.
Dekkers IA, van der Molen AJ. Propensity Score Matching as a Substitute for Randomized Controlled Trials on Acute Kidney Injury After Contrast Media Administration: A Systematic Review. AJR Am J Roentgenol 2018;211(4):822–6. doi: 10.2214/AJR.17.19499.
McDonald JS, McDonald RJ, Lieske JC, Carter RE, Katzberg RW, Williamson EE, et al. Risk of Acute Kidney Injury, Dialysis, and Mortality in Patients With Chronic Kidney Disease After Intravenous Contrast Material Exposure. Mayo Clin Proc 2015;90(8):1046–53. doi: 10.1016/j.mayocp.2015.05.016.
Kidoh M, Nakaura T, Awai K, Matsunaga Y, Tanoue K, Harada K, et al. Low-contrast dose protection protocol for diagnostic computed tomography in patients at high-risk for contrastinduced nephropathy. J Comput Assist Tomogr 2013;37(2):289–96. doi: 10.1097/RCT.0b013e318279bd20.
Enderlein G. Daniel, Wayne W.: Biostatistics — A Foundations for Analysis in the Health Sciences. Wiley & Sons, New York—Chichester—Brisbane—Toronto—Singapore, 6th ed. 1995, 780 S.,£58.—, ISBN 0–471–58852-0 (cloth). Biometrical Journal 2007;37(6):744–. doi: 10.1002/bimj.4710370610.
McDonald JS, McDonald RJ, Williamson EE, Kallmes DF, Kashani K. Post-contrast acute kidney injury in intensive care unit patients: a propensity score-adjusted study. Intensive Care Med 2017;43(6):774–84. doi: 10.1007/s00134-017-4699-y.
Stacul F, Bertolotto M, Thomsen HS, Pozzato G, Ugolini D, Bellin MF, et al. Iodine-based contrast media, multiple myeloma and monoclonal gammopathies: literature review and ESUR Contrast Media Safety Committee guidelines. Eur Radiol 2018;28(2):683–91. doi: 10.1007/s00330-017-5023-5.
Crowley MP, Prabhakaran VN, Gilligan OM. Incidence of Contrast-Induced Nephropathy in Patients with Multiple Myeloma Undergoing Contrast-Enhanced Procedures. Pathol Oncol Res 2018;24(4):915–9. doi: 10.1007/s12253-017-0300-9.