การใช้ Furosemide stress test ในการประเมินการฟื้นตัวของไตระหว่างการรักษาบำบัดทดแทนไต แบบต่อเนื่อง: การศึกษานำร่องประเภทการทดลองสุ่ม แบบมีกลุ่มควบคุม (FST-STOP)
Main Article Content
บทคัดย่อ
บทนำ: ระยะเวลาที่เหมาะสมในการหยุดการรักษาบำบัดทดแทนไตแบบต่อเนื่อง (continuous renal replacement therapy, CRRT) ยังไม่มีระยะเวลาที่แน่นอน มีข้อมูลไม่มากในการนำ furosemide stress test (FST) มาใช้ในการประเมินการฟื้นตัวของไต การศึกษานี้ได้ทำการสืบค้นว่า FST จะช่วยทำให้หยุดการบำบัดทดแทนไตได้หรือไม่
ระเบียบวิธีวิจัย: การศึกษานี้ได้รวบรวมผู้ป่วยวิกฤตที่มีภาวะไตวายเฉียบพลันระยะที่ 3 ที่ได้รับการรักษาบำบัดทดแทนไตแบบต่อเนื่องมาอย่างน้อย 48 ชั่วโมง ผู้เข้าร่วมการศึกษาจะถูกสุ่ม 1:1 แบ่งเป็นกลุ่มที่ได้รับการทำ protocol-based FST (PB-FST) และกลุ่มที่ได้รับการรักษามาตรฐาน ผลลัพธ์หลักคือจำนวนผู้ป่วยที่สามารถหยุดการบำบัดทดแทนไตได้
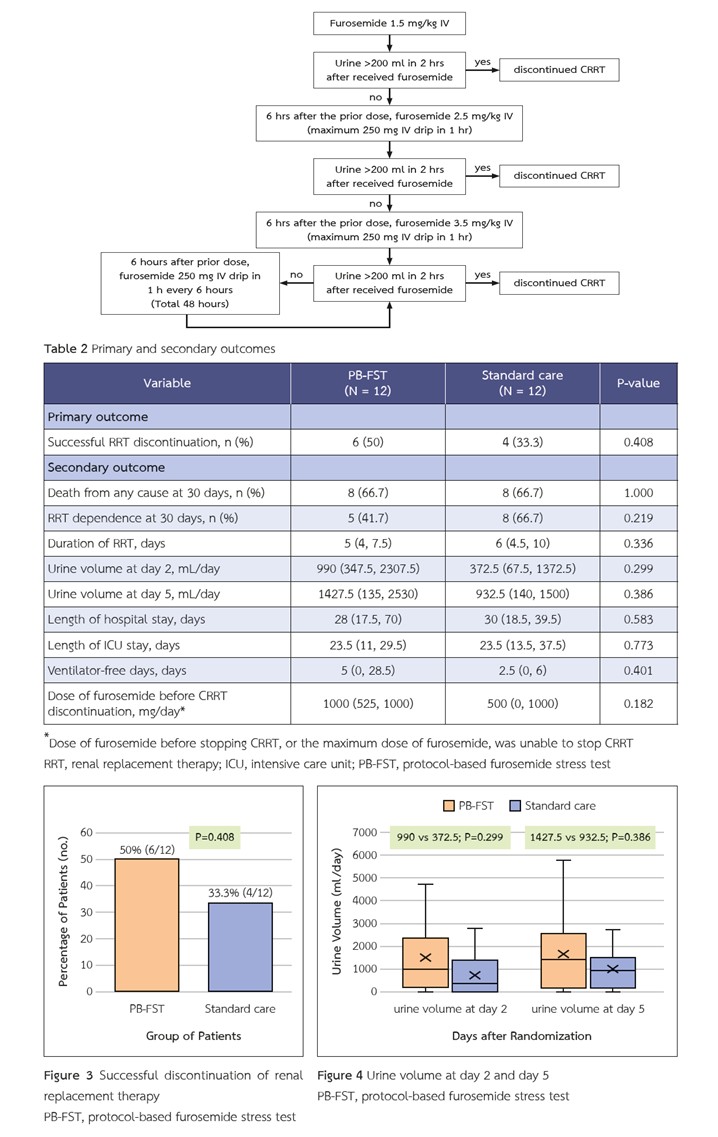
ผลการวิจัย: มีผู้เข้าร่วมการศึกษาทั้งหมด 24 รายในการศึกษานี้ โดยมีอายุเฉลี่ย 70.3±15.6 ปี และค่ามัธยฐานของอัตราการกรองของไต (estimated glomerular filtration rate, eGFR) อยู่ที่ 57.5 มล./นาที/1.73 ตร.ม. (ค่าพิสัยระหว่างควอร์ไทล์, 47.5-77) พบว่า สามารถหยุดการบำบัดทดแทนไตได้สำเร็จ 6 ราย จาก 12 ราย (50%) ในกลุ่ม PB-FST และ 4 ราย จาก 12 ราย (33.3%) ในกลุ่มการรักษาตามมาตรฐาน (P = 0.408) ในวันที่ 2 ปริมาณปัสสาวะในกลุ่ม PB-FST มี 990 มล.ต่อวัน และ 372.5 มล.ต่อวัน ในกลุ่มที่ได้รับการรักษามาตรฐาน (P = 0.299) หลังจากนั้นในวันที่ 5 พบปริมาณปัสสาวะ 1427.5 มล.ต่อวัน และ 932.5 มล.ต่อวัน ตามลำดับ (P = 0.386)
สรุป: PB-FST อาจสามารถนำมาใช้ประเมินการฟื้นตัวของไตระหว่างการรักษาบำบัดทดแทนไตแบบต่อเนื่องได้ อย่างไรก็ตามจำนวนตัวอย่างที่น้อยอาจส่งผลต่อความเชื่อมั่นทางสถิติของผลการศึกษา
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Herrera-Gutierrez ME, Seller-Perez G, Sanchez-Izquierdo-Riera JA, Maynar-Moliner J, group Ci. Prevalence of acute kidney injury in intensive care units: the “COrte de prevalencia de disFuncion RenAl y DEpuracion en criticos” point-prevalence multicenter study. J Crit Care 2013;28(5):687–94. doi: 10.1016/j.jcrc.2013.05.019.
Wahrhaftig Kde M, Correia LC, de Souza CA. [RIFLE Classification: prospective analysis of the association with mortality in critical ill patients]. J Bras Nefrol 2012;34(4):369–77. doi: 10.5935/0101-2800.20120027.
Salathe C, Poli E, Altarelli M, Bianchi NA, Schneider AG. Epidemiology and outcomes of elderly patients requiring renal replacement therapy in the intensive care unit: an observational study. BMC Nephrol 2021;22(1):101. doi: 10.1186/s12882-021-02302-4.
Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal failure in critically ill patients: a multinational, multicenter study. JAMA 2005;294(7):813–8. doi: 10.1001/jama.294.7.813.
Park S, Lee S, Jo HA, Han K, Kim Y, An JN, et al. Epidemiology of continuous renal replacement therapy in Korea: Results from the National Health Insurance Service claims database from 2005 to 2016. Kidney Res Clin Pract 2018;37(2):119–29. doi: 10.23876/j.krcp.2018.37.2.119.
Gaudry S, Hajage D, Schortgen F, Martin-Lefevre L, Pons B, Boulet E, et al. Initiation Strategies for Renal-Replacement Therapy in the Intensive Care Unit. N Engl J Med 2016;375(2):122–33. doi: 10.1056/NEJMoa1603017.
Zarbock A, Kellum JA, Schmidt C, Van Aken H, Wempe C, Pavenstadt H, et al. Effect of Early vs Delayed Initiation of Renal Replacement Therapy on Mortality in Critically Ill Patients With Acute Kidney Injury: The ELAIN Randomized Clinical Trial. JAMA 2016;315(20):2190–9. doi: 10.1001/jama.2016.5828.
Barbar SD, Clere-Jehl R, Bourredjem A, Hernu R, Montini F, Bruyere R, et al. Timing of Renal-Replacement Therapy in Patients with Acute Kidney Injury and Sepsis. N Engl J Med 2018;379(15):1431–42. doi: 10.1056/NEJMoa1803213.
Investigators S-A, Canadian Critical Care Trials G, Australian, New Zealand Intensive Care Society Clinical Trials G, United Kingdom Critical Care Research G, Canadian Nephrology Trials N, et al. Timing of Initiation of Renal-Replacement Therapy in Acute Kidney Injury. N Engl J Med 2020;383(3):240–51. doi: 10.1056/NEJMoa2000741.
Gaudry S, Hajage D, Martin-Lefevre L, Lebbah S, Louis G, Moschietto S, et al. Comparison of two delayed strategies for renal replacement therapy initiation for severe acute kidney injury (AKIKI 2): a multicentre, open-label, randomised, controlled trial. Lancet 2021;397(10281):1293–300. doi: 10.1016/S0140-6736(21)00350-0.
Akhoundi A, Singh B, Vela M, Chaudhary S, Monaghan M, Wilson GA, et al. Incidence of Adverse Events during Continuous Renal Replacement Therapy. Blood Purif 2015;39(4):333–9. doi: 10.1159/000380903.
Chawla LS, Davison DL, Brasha-Mitchell E, Koyner JL, Arthur JM, Shaw AD, et al. Development and standardization of a furosemide stress test to predict the severity of acute kidney injury. Crit Care 2013;17(5):R207. doi: 10.1186/cc13015.
Lumlertgul N, Peerapornratana S, Trakarnvanich T, Pongsittisak W, Surasit K, Chuasuwan A, et al. Early versus standard initiation of renal replacement therapy in furosemide stress test non-responsive acute kidney injury patients (the FST trial). Crit Care 2018;22(1):101. doi: 10.1186/s13054-018-2021-1.
Koyner JL, Davison DL, Brasha-Mitchell E, Chalikonda DM, Arthur JM, Shaw AD, et al. Furosemide Stress Test and Biomarkers for the Prediction of AKI Severity. J Am Soc Nephrol 2015;26(8):2023–31. doi: 10.1681/ASN.2014060535.
Zhang K, Zhang H, Zhao C, Hu Z, Shang J, Chen Y, et al. The furosemide stress test predicts the timing of continuous renal replacement therapy initiation in critically ill patients with acute kidney injury: a double-blind prospective intervention cohort study. Eur J Med Res 2023;28(1):149. doi: 10.1186/s40001-023-01092-9.
Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract 2012;120(4):c179–84. doi: 10.1159/000339789.
Zavada J, Hoste E, Cartin-Ceba R, Calzavacca P, Gajic O, Clermont G, et al. A comparison of three methods to estimate baseline creatinine for RIFLE classification. Nephrol Dial Transplant 2010;25(12):3911–8. doi: 10.1093/ndt/gfp766.
Lewis M, Bromley K, Sutton CJ, McCray G, Myers HL, Lancaster GA. Determining sample size for progression criteria for pragmatic pilot RCTs: the hypothesis test strikes back! Pilot Feasibility Stud 2021;7(1):40. doi: 10.1186/s40814-021-00770-x.
Novak JE, Ellison DH. Diuretics in States of Volume Overload: Core Curriculum 2022. Am J Kidney Dis 2022;80(2):264–76. doi: 10.1053/j.ajkd.2021.09.029.
Gautam SC, Srialluri N, Jaar BG. Strategies for Continuous Renal Replacement Therapy De-escalation. Kidney360 2021;2(7):1166–9. doi: 10.34067/KID.0000912021.
Bagshaw SM, Delaney A, Haase M, Ghali WA, Bellomo R. Loop diuretics in the management of acute renal failure: a systematic review and meta-analysis. Crit Care Resusc 2007;9(1):60–8. doi: 10.1016/s1441-2772(23)02007-0.
van der Voort PH, Boerma EC, Koopmans M, Zandberg M, de Ruiter J, Gerritsen RT, et al. Furosemide does not improve renal recovery after hemofiltration for acute renal failure in critically ill patients: a double blind randomized controlled trial. Crit Care Med 2009;37(2):533–8. doi: 10.1097/CCM.0b013e318195424d.
Li C, Ren Q, Li X, Han H, Xie K, Wang G. Association between furosemide administration and clinical outcomes in patients with sepsis-associated acute kidney injury receiving renal replacement therapy: a retrospective observational cohort study based on MIMIC-IV database. BMJ Open 2023;13(7):e074046. doi: 10.1136/bmjopen-2023-074046.