การศึกษาแบบสุ่มและข้ามกลุ่มเพื่อเปรียบเทียบการสูญเสียกรดอะมิโนระหว่างการฟอกเลือดด้วยเครื่องไตเทียม ระหว่างวิธีการให้สารละลายกรดอะมิโน ควบคู่กับเดกซ์โทรส เเละการให้สารละลายกรดอะมิโนภายหลังการให้เดกซ์โทรส
Main Article Content
บทคัดย่อ
บทนำ: ในผู้ป่วยที่ได้รับอาหารทางหลอดเลือดดำระหว่างการฟอกเลือดด้วยเครื่องไตเทียม พบว่ามีการสูญเสียกรดอะมิโนเพิ่มขึ้นทางน้ำยาฟอกเลือด ปัจจุบันมีวิธีมาตรฐาน 2 วิธี ในการให้อาหารทางหลอดเลือดดำสำหรับสูตรอาหารที่ไม่มีไขมัน ได้แก่ การให้กรดอะมิโนร่วมกับเดกซ์โทรสพร้อมกัน และการให้เดกซ์โทรสก่อนแล้วตามด้วยกรดอะมิโน อย่างไรก็ตามยังไม่เคยมีการศึกษาถึงความแตกต่างของการสูญเสียกรดอะมิโนทางน้ำยาฟอกเลือด
ระเบียบวิธีวิจัย: การศึกษานี้เป็นการศึกษาแบบสุ่มและข้ามกลุ่มในผู้ป่วยจำนวน 10 คน ที่มีข้อบ่งชี้ของการให้อาหารเสริมทางหลอดเลือดดำโดยผู้ป่วยจะได้รับการสุ่มเพื่อใด้รับกรดอะมิโนควบคู่กับสารละลายเดกซ์โทรสพร้อมกัน หรือ ได้รับสารละลายเดกซ์โทรสก่อนแล้วตามด้วย
กรดอะมิโน หลังจากนั้น 1 สัปดาห์จึงมีการสลับวิธีการให้ระหว่างทั้ง 2 กลุ่ม ผลลัพธ์ของการศึกษา คือ ความแตกต่างของความเข้มข้นของกรดอะมิโนในพลาสมาก่อนและหลังการฟอกเลือด และความเข้มข้นของ กรดอะมิโนในน้ำยาฟอกเลือด นอกจากนี้ยังมีการเก็บข้อมูลความดันโลหิต และความเข้มข้นของกลูโคสระหว่างการฟอกเลือดด้วย
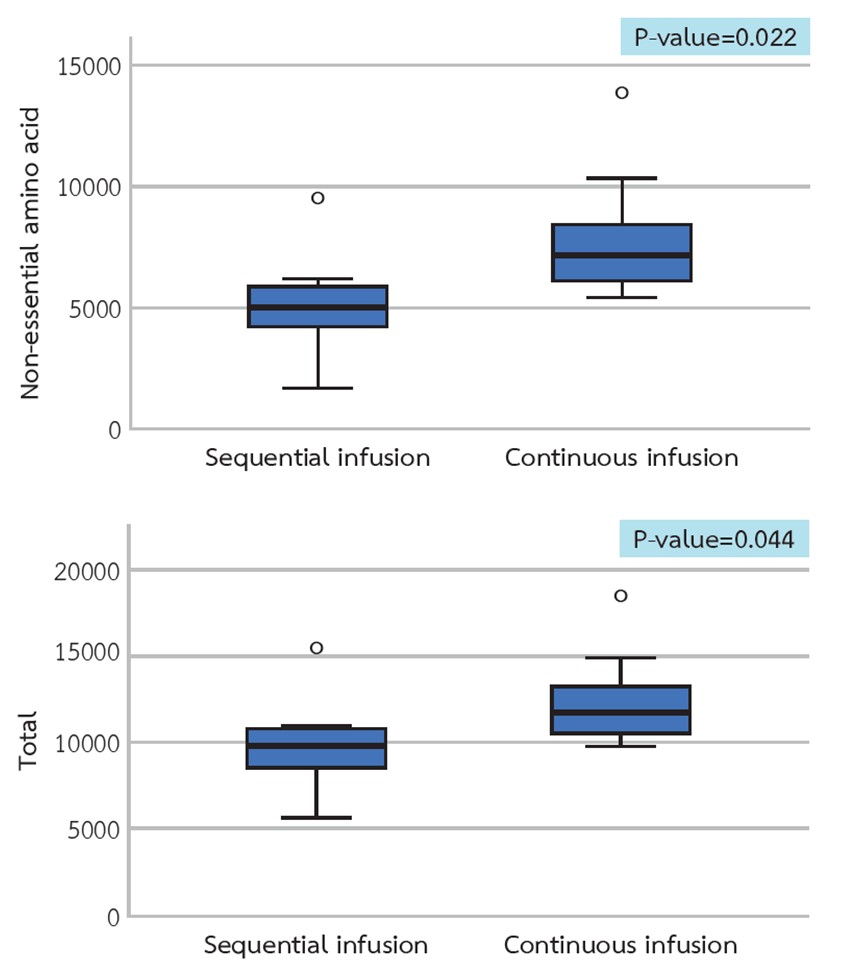
ผลการวิจัย: ไม่พบความแตกต่างกันของการลดลงของความเข้มข้น ของกรดอะมิโนที่จำเป็น กรดอะมิโนที่ไม่จำเป็น และ กรดอะมิโนทั้งหมดในพลาสมาระหว่างทั้ง 2 วิธี อย่างไรพบว่ามีความเข้มข้นของกรดอะมิโนที่ไม่จำเป็น และกรดอะมิโนทั้งหมดในน้ำยาฟอกเลือดสูงกว่าในกลุ่มที่ได้รับกรดอะมิโนและเดกซ์โทรสพร้อมกัน ในกลุ่มที่ได้รับเดกซ์โทรส ก่อนกรดอะมิโนพบว่ามีความเข้มข้นของน้ำตาลสูงกว่าในชั่วโมงที่ 2 และต่ำกว่าในชั่วโมงที่ 4 ของการฟอกเลือด และมีผู้ป่วย 2 คนมีความดันโลหิตต่ำ
สรุป: การให้อาหารเสริมทางหลอดเลือดดำโดยวิธีการให้กรดอะมิโนพร้อมกับเดกซ์โทรสระหว่างการฟอกเลือด อาจทำให้มีการสูญเสียกรดอะมิโนในน้ำยาฟอกเลือดมากกว่าการให้เดกซ์โทรสก่อนแล้วตามด้วยการให้กรดอะมิโน
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Hanna RM, Ghobry L, Wassef O, Rhee CM, Kalantar-Zadeh K. A Practical Approach to Nutrition, Protein-Energy Wasting, Sarcopenia, and Cachexia in Patients with Chronic Kidney Disease. Blood Purif. 2020;49(1-2):202-11.
Carrero JJ, Stenvinkel P, Cuppari L, Ikizler TA, Kalantar-Zadeh K, Kaysen G, et al. Etiology of the protein-energy wasting syndrome in chronic kidney disease: a consensus statement from the International Society of Renal Nutrition and Metabolism (ISRNM). J Ren Nutr. 2013;23(2):77-90.
Lazarus JM. Nutrition in hemodialysis patients. Am J Kidney Dis. 1993;21(1):99-105.
Ikizler TA, Flakoll PJ, Parker RA, Hakim RM. Amino acid and albumin losses during hemodialysis. Kidney Int. 1994;46(3):830-7.
Navarro JF, Mora C, León C, Martín-Del Río R, Macía ML, Gallego E, et al. Amino acid losses during hemodialysis with polyacrylonitrile membranes: effect of intradialytic amino acid supplementation on plasma amino acid concentrations and nutritional variables in nondiabetic patients. Am J Clin Nutr. 2000;71(3):765-73.
Holeček M. Branched-chain amino acids in health and disease: metabolism, alterations in blood plasma, and as supplements. Nutr Metab (Lond). 2018;15:33.
Holecek M, Sprongl L, Tilser I, Tichý M. Leucine and protein metabolism in rats with chronic renal insufficiency. Exp Toxicol Pathol. 2001;53(1):71-6.
Alvestrand A, Fürst P, Bergström J. Plasma and muscle free amino acids in uremia: influence of nutrition with amino acids. Clin Nephrol. 1982;18(6):297-305.
Schauder P, Matthaei D, Henning HV, Scheler F, Langenbeck U. Blood levels of branched-chain amino acids and alpha-ketoacids in uremic patients given keto analogues of essential amino acids. Am J Clin Nutr. 1980;33(7):1660-6.
Sweatt AJ, Garcia-Espinosa MA, Wallin R, Hutson SM. Branched-chain amino acids and neurotransmitter metabolism: expression of cytosolic branched-chain aminotransferase (BCATc) in the cerebellum and hippocampus. J Comp Neurol. 2004;477(4):360-70.
Deferrari G, Garibotto G, Robaudo C, Ghiggeri GM, Tizianello A. Brain metabolism of amino acids and ammonia in patients with chronic renal insufficiency. Kidney Int. 1981;20(4):505-10.
Garibotto G, Paoletti E, Fiorini F, Russo R, Robaudo C, Deferrari G, et al. Peripheral metabolism of branched-chain keto acids in patients with chronic renal failure. Miner Electrolyte Metab. 1993;19(1):25-31.
Cano NJ. Branched-chain amino-acid metabolism in renal failure. J Ren Nutr. 2009;19(5 Suppl):S22-4.
Jensen J, Rustad PI, Kolnes AJ, Lai YC. The role of skeletal muscle glycogen breakdown for regulation of insulin sensitivity by exercise. Front Physiol. 2011;2:112.
Sacca L, Hendler R, Sherwin RS. Hyperglycemia inhibits glucose production in man independent of changes in glucoregulatory hormones. J Clin Endocrinol Metab. 1978;47(5):1160-3.
Javed K, Fairweather SJ. Amino acid transporters in the regulation of insulin secretion and signalling. Biochem Soc Trans. 2019;47(2):571-90.
Wolfson M, Jones MR, Kopple JD. Amino acid losses during hemodialysis with infusion of amino acids and glucose. Kidney Int. 1982;21(3):500-6.