ยาจับโพแทสเซียมสำหรับภาวะโพแทสเซียมในเลือดสูงในผู้ป่วยโรคไตเรื้อรัง
Main Article Content
บทคัดย่อ
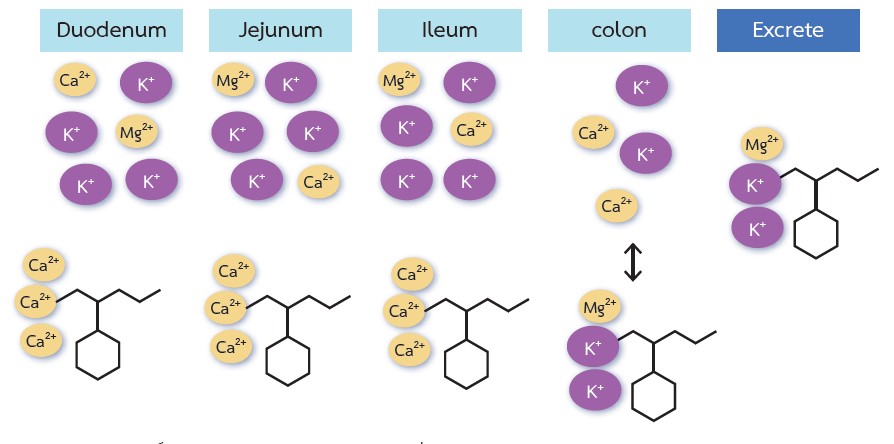
ภาวะโพแทสเซียมในเลือดสูงเป็นภาวะแทรกซ้อนที่อาจเป็นอันตรายถึงแก่ชีวิตในโรคไตเรื้อรังโดยเฉพาะในผู้ป่วยที่มีอัตราการกรองของไตต่ำกว่า 45 มิลลิลิตร/นาที/1.73 ตารางเมตร ในภาวะปกติพบว่าร้อยละ 10 ของการขับโพแทสเซียมออกจากร่างกายเกิดขึ้นที่ลำไส้ใหญ่ ส่วนที่เหลืออีกร้อยละ 90 เกิดขึ้นที่ไต อย่างไรก็ตามลำไส้ใหญ่จะกลายเป็นตำแหน่งสำคัญที่ช่วยขับโพแทสเซียมออกจากร่างกายในผู้ป่วยโรคไตเรื้อรัง แม้ว่ากลุ่มยาต้านระบบเรนิน-แองจิโอเทนซิน-อัลโดสเตอโรน ช่วยชะลอการเสื่อมของไตและลดภาวะแทรกซ้อนของโรคหัวใจและหลอดเลือด แต่ผู้ป่วยที่มีภาวะโพแทสเซียมในเลือดสูงมักจะถูกลดหรือหยุดยาดังกล่าว patiromer และ sodium zirconium cyclosilicate (SZC) เป็นยาจับโพแทสเซียมซึ่งเป็นทางเลือกแทนยา sodium polystyrene sulfonate เนื่องจากมีผลข้างเคียงต่อระบบทางเดินอาหารน้อยกว่า จากการศึกษาแบบสุ่มและมีกลุ่มควบคุมในผู้ป่วยที่มีภาวะโพแทสเซียมในเลือดสูงพบว่า patiromer และ SZC มีประสิทธิภาพดีในการลดระดับโพแทสเซียมในเลือดและมีความปลอดภัย ยาจับโพแทสเซียมทั้ง 2 ชนิดนี้ อาจช่วยให้ผู้ป่วยโรคไตเรื้อรังที่มีความเสี่ยงต่อการเกิดภาวะโพแทสเซียมในเลือดสูงนั้น สามารถใช้กลุ่มยาต้านระบบเรนิน-แองจิโอเทนซิน-อัลโดสเตอโรน ได้อย่างมีประสิทธิภาพมากยิ่งขึ้น ส่วนผลกระทบของ patiromer และ SZC ต่ออัตราการรอดชีวิตของผู้ป่วยโรคไตเรื้อรังนั้นต้องรอการศึกษาเพิ่มเติมที่มีการติดตามผู้ป่วยนานเพียงพอต่อไป
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Gilligan S, Raphael KL. Hyperkalemia and Hypokalemia in CKD: Prevalence, Risk Factors, and Clinical Outcomes. Adv Chronic Kidney Dis. 2017;24:315-8.
Luo J, Brunelli SM, Jensen DE, Yang A. Association between Serum Potassium and Outcomes in Patients with Reduced Kidney Function. Clin J Am Soc Nephrol. 2016;11:90-100.
Thomsen RW, Nicolaisen SK, Hasvold P, Sanchez RG, Pedersen L, Adelborg K, et al. Elevated potassium levels in patients with chronic kidney disease: occurrence, risk factors and clinical outcomes-a Danish population-based cohort study. Nephrol Dial Transplant. 2018;33(9):1610-20.
Núñez J, Bayés-Genís A, Zannad F, Rossignol P, Núñez E, Bodí V, et al. Long-Term Potassium Monitoring and Dynamics in Heart Failure and Risk of Mortality. Circulation. 2018;137:1320-30.
Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, Sakhuja A, Mao MA, Erickson SB. Impact of admission serum potassium on mortality in patients with chronic kidney disease and cardiovascular disease. QJM. 2017;110:713-9.
Collins AJ, Pitt B, Reaven N, Funk S, McGaughey K, Wilson D, et al. Association of Serum Potassium with All-Cause Mortality in Patients with and without Heart Failure, Chronic Kidney Disease, and/or Diabetes. Am J Nephrol. 2017;46:213-21.
Kovesdy CP. Management of hyperkalaemia in chronic kidney disease. Nat Rev Nephrol. 2014;10:653-62.
Epstein M. Hyperkalemia constitutes a constraint for implementing renin-angiotensin-aldosterone inhibition: the widening gap between mandated treatment guidelines and the real-world clinical arena. Kidney Int Suppl (2011). 2016;6:20-8.
Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Jr., Colvin MM, et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017;136:e137-61.
Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes-2019. Diabetes Care. 2019; 42 Suppl 1:S103-23.
Epstein M, Reaven NL, Funk SE, McGaughey KJ, Oestreicher N, Knispel J. Evaluation of the treatment gap between clinical guidelines and the utilization of renin-angiotensin-aldosterone system inhibitors. Am J Manag Care. 2015;21 Suppl 11:S212-20.
Palmer BF, Clegg DJ. Physiology and Pathophysiology of Potassium Homeostasis: Core Curriculum 2019. Am J Kidney Dis. 2019;74:682-95.
Tamargo J, Caballero R, Delpon E. New drugs for the treatment of hyperkalemia in patients treated with renin-angiotensinaldosterone system inhibitors--hype or hope?. Discovery Medicine. 2014 Nov 1;18(100):249-54.
Mathialahan T, Maclennan KA, Sandle LN, Verbeke C, Sandle GI. Enhanced large intestinal potassium permeability in end-stage renal disease. J Pathol. 2005;206:46-51.
van Dinter TG, Jr., Fuerst FC, Richardson CT, Ana CA, Polter DE, Fordtran JS, et al. Stimulated active potassium secretion in a patient with colonic pseudo-obstruction: a new mechanism of secretory diarrhea. Gastroenterology. 2005;129:1268-73.
Yamada S, Inaba M. Potassium Metabolism and Management in Patients with CKD. Nutrients. 2021;13(6):1751.
Harel Z, Harel S, Shah PS, Wald R, Perl J, Bell CM. Gastrointestinal adverse events with sodium polystyrene sulfonate (Kayexalate) use: a systematic review. Am J Med. 2013;126:264.e9-24.
Wong SWS, Zhang G, Norman P, Welihinda H, Wijeratne DT. Polysulfonate Resins in Hyperkalemia: A Systematic Review. Can J Kidney Health Dis. 2020;7:2054358120965838.
U.S. Food and Drug Administration. Drug Approvals and Databases:VELTASSA 2015 [December 18, 2022]. Available from: http://www.fda.gov/Drugs/InformationOnDrugs/ucm474619.htm.
Li L, Harrison SD, Cope MJ, Park C, Lee L, Salaymeh F, et al. Mechanism of Action and Pharmacology of Patiromer, a Nonabsorbed Cross-Linked Polymer That Lowers Serum Potassium Concentration in Patients With Hyperkalemia. J Cardiovasc Pharmacol Ther. 2016;21:456-65.
Lesko LJ, Offman E, Brew CT, Garza D, Benton W, Mayo MR, et al. Evaluation of the Potential for Drug Interactions With Patiromer in Healthy Volunteers. J Cardiovasc Pharmacol Ther. 2017;22(5):434-46.
Pitt B, Anker SD, Bushinsky DA, Kitzman DW, Zannad F, Huang IZ. Evaluation of the efficacy and safety of RLY5016, a polymeric potassium binder, in a double-blind, placebocontrolled study in patients with chronic heart failure (the PEARL-HF) trial. Eur Heart J. 2011;32:820-8.
Weir MR, Bakris GL, Bushinsky DA, Mayo MR, Garza D, Stasiv Y, et al. Patiromer in patients with kidney disease and hyperkalemia receiving RAAS inhibitors. N Engl J Med. 2015;372:211-21.
Bakris GL, Pitt B, Weir MR, Freeman MW, Mayo MR, Garza D, et al. Effect of Patiromer on Serum Potassium Level in Patients With Hyperkalemia and Diabetic Kidney Disease: The AMETHYST-DN Randomized Clinical Trial. JAMA. 2015;314:151-61.
Kovesdy CP, Rowan CG, Conrad A, Spiegel DM, Fogli J, Oestreicher N, et al. Real-World Evaluation of Patiromer for the Treatment of Hyperkalemia in Hemodialysis Patients. Kidney Int Rep. 2019;4(2):301-9.
Butler J, Anker SD, Lund LH, Coats AJS, Filippatos G, Siddiqi TJ, et al. Patiromer for the management of hyperkalemia in heart failure with reduced ejection fraction: the DIAMOND trial. Eur Heart J. 2022;43(41):4362-73.
Meaney CJ, Beccari MV, Yang Y, Zhao J. Systematic Review and Meta-Analysis of Patiromer and Sodium Zirconium Cyclosilicate: A New Armamentarium for the Treatment of Hyperkalemia. Pharmacotherapy. 2017;37:401-11.
Shrestha DB, Budhathoki P, Sedhai YR, Baniya R, Cable CA, Kashiouris MG, et al. Patiromer and Sodium Zirconium Cyclosilicate in Treatment of Hyperkalemia: A Systematic Review and Meta-Analysis. Curr Ther Res Clin Exp. 2021;95:100635.
Chaitman M, Dixit D, Bridgeman MB. Potassium-Binding Agents for the Clinical Management of Hyperkalemia. P T. 2016;41:43-50.
U.S. Food and Drug Administration. Drug Approvals and Databases:LOKELMA 2018 [December 18, 2022]. Available from: https://www.fda.gov/Drugs/InformationOnDrugs/ucm609666.html.
Stavros F, Yang A, Leon A, Nuttall M, Rasmussen HS. Characterization of structure and function of ZS-9, a K+ selective ion trap. PLoS One. 2014;9:e114686.
Fishbane S, Ford M, Fukagawa M, McCafferty K, Rastogi A, Spinowitz B, et al. A Phase 3b, Randomized, Double-Blind, Placebo-Controlled Study of Sodium Zirconium Cyclosilicate for Reducing the Incidence of Predialysis Hyperkalemia. J Am Soc Nephrol. 2019;30:1723-33.
Ash SR, Singh B, Lavin PT, Stavros F, Rasmussen HS. A phase 2 study on the treatment of hyperkalemia in patients with chronic kidney disease suggests that the selective potassium trap, ZS-9, is safe and efficient. Kidney Int. 2015;88:404-11.
Kosiborod M, Rasmussen HS, Lavin P, Qunibi WY, Spinowitz B, Packham D, et al. Effect of sodium zirconium cyclosilicate on potassium lowering for 28 days among outpatients with hyperkalemia: the HARMONIZE randomized clinical trial. JAMA. 2014;312:2223-33.
Roger SD, Spinowitz BS, Lerma EV, Fishbane S, Ash SR, Martins JG, et al. Sodium zirconium cyclosilicate increases serum bicarbonate concentrations among patients with hyperkalaemia: exploratory analyses from three randomized, multi-dose, placebo-controlled trials. Nephrol Dial Transplant. 2021;36:871-83.
Roger SD, Spinowitz BS, Lerma EV, Singh B, Packham DK, Al-Shurbaji A, et al. Efficacy and Safety of Sodium Zirconium Cyclosilicate for Treatment of Hyperkalemia: An 11-Month Open-Label Extension of HARMONIZE. Am J Nephrol. 2019;50:473-80.
Anker SD, Kosiborod M, Zannad F, Piña IL, McCullough PA, Filippatos G, et al. Maintenance of serum potassium with sodium zirconium cyclosilicate (ZS-9) in heart failure patients: results from a phase 3 randomized, double-blind, placebo-controlled trial. Eur J Heart Fail. 2015;17:1050-6.
Peacock WF, Rafique Z, Vishnevskiy K, Michelson E, Vishneva E, Zvereva T, et al. Emergency Potassium Normalization Treatment Including Sodium Zirconium Cyclosilicate: A Phase II, Randomized, Double-blind, Placebo-controlled Study (ENERGIZE). Acad Emerg Med. 2020;27:475-86.
Spinowitz BS, Fishbane S, Pergola PE, Roger SD, Lerma EV, Butler J, et al. Sodium Zirconium Cyclosilicate among Individuals with Hyperkalemia: A 12-Month Phase 3 Study. Clin J Am Soc Nephrol. 2019;14(6):798-809.
Roger SD, Lavin PT, Lerma EV, McCullough PA, Butler J, Spinowitz BS, et al. Long-term safety and efficacy of sodium zirconium cyclosilicate for hyperkalaemia in patients with mild/moderate versus severe/end-stage chronic kidney disease: comparative results from an open-label, Phase 3 study. Nephrol Dial Transplant. 2021;36(1):137-50.