บทบาทของ sFlt-1 / PlGF และ Endoglin ต่อภาวะครรภ์เป็นพิษและการทำงานของไตในระยะยาว
Main Article Content
บทคัดย่อ
บทนำ: ภาวะครรภ์เป็นพิษ (preeclampsia) เป็นภาวะแทรกซ้อนของการตั้งครรภ์ที่ส่งผลต่อการเกิดโรคไตเรื้อรัง เนื่องจากการบาดเจ็บของเซลล์ผนังหลอดเลือดร่วมกับการสูญเสียเซลล์โพโดไซต์ ปัจจุบันมีการใช้ดัชนีชี้วัดทางชีวภาพ ได้แก่ soluble fms-like tyrosine kinase-1 (sFLt-1), placental growth factor (PlGF), สัดส่วน sFlt-1 ต่อ PlGF (sFlt-1/PlGF) และ endoglin เพื่อช่วยในการวินิจฉัยแยกภาวะครรภ์เป็นพิษกับโรคอื่น การศึกษานี้จึงมีวัตถุประสงค์เพื่อศึกษาความสัมพันธ์ของดัชนีชี้วัดทางชีวภาพดังกล่าวและการทำงานของไต (eGFR) ความดันโลหิต และสัดส่วนแอลบูมินต่อครีแอทินินในปัสสาวะ (UACR) ในระยะยาว
วิธีการศึกษา: การศึกษาเชิงสังเกตแบบไปข้างหน้า (prospective observational study) โดยรวบรวมสตรีตั้งครรภ์ที่มีอายุตั้งแต่ 18 ปี ที่ได้รับการวินิจฉัยว่ามีภาวะครรภ์เป็นพิษ ทุกคนจะได้วัดความดันโลหิตและรับการตรวจระดับ sFlt-1, PlGF และ endoglin ก่อนการคลอดบุตร หลังจากนั้นติดตามนัดผู้ป่วยเพื่อมาวัดความดันโลหิต ค่าการทำงานของไต (eGFR) และ UACR ที่ระยะเวลา 3 เดือนและ 1 ปี ผลการศึกษาจะดูสหสัมพันธ์ (correlation) ของดัชนีชี้วัดดังกล่าวกับค่า eGFR, ความดันโลหิตและ UACR ที่ 1 ปี
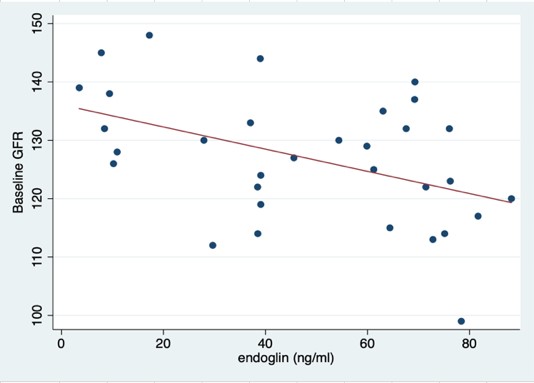
ผลการศึกษา: จากหญิงตั้งครรภ์ที่มีภาวะครรภ์เป็นพิษทั้งหมด 32 ราย และมีภาวะครรภ์เป็นพิษชนิดรุนแรงและมีภาวะตับอักเสบร่วมด้วย (HELLP syndrome) จำนวน 1 ราย พบว่าค่า eGFR ลดลงอย่างมีนัยสำคัญ โดย eGFR ลดลงจาก 128.20±10.34 เป็น 120.75±10.166 มล./นาที/1.73 ตร.ม. (p=0.001) ที่ 3 เดือนและ 126.71±9.948 เป็น 114.29±11.274 มล./นาที/1.73 ตร.ม. (p < 0.001) ที่ 1 ปี เมื่อเทียบกับวันที่วินิจฉัยครรภ์เป็นพิษตามลำดับ และพบว่าระดับ endoglin ที่เพิ่มขึ้นสัมพันธ์กับการลดลงของค่า eGFR ณ เวลาที่วินิจฉัยโรค แต่เมื่อติดตามไป 1 ปี ไม่พบความสัมพันธ์ของระดับ sFlt-1, ระดับ PlGF, สัดส่วน sFlt-1/PlGF และระดับ endoglin กับค่า eGFR, ความดันโลหิต และ UACR
สรุป: ภาวะครรภ์เป็นพิษส่งผลต่อการทำงานของไตในระยะยาว แต่พบว่าดัชนีชี้วัดทางชีวภาพ ได้แก่ ระดับ sFlt-1 ระดับ PlGF สัดส่วน sFlt1/PlGF และระดับ endoglin ไม่มีความสัมพันธ์กับค่า eGFR, ความดันโลหิต และ UACR ในระยะยาว
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Rudra CB, Williams MA. Monthly variation in preeclampsia prevalence: Washington State, 1987-2001, J Matern Fetal Neonatal Med. 2005;18(5):319-24.
Bellamy L, Casas JP, Hingorani AD, Williams DJ. Preeclampsia and risk of cardiovascular disease and cancer in later life: systematic review and meta-analysis. Br Med J. 2007;335(7627):974-7.
Magee LA, von Dadelszen P. Pre-eclampsia and increased cardiovascular risk. Br Med J. 2007 335(7627):945–6.
Airoldi J, Weinstein L. Clinical significance of proteinuria in pregnancy. Obstet Gynecol Surv. 2007;62(2) 117-24.
Drakeley AJ, Le Roux PA, Anthony J, Penny J. Acute renal failure complicating severe preeclampsia requiring admission to an obstetric intensive care unit. Am J Obstet Gynecol. 2002;186(2):253-6.
McDonald SD, Han Z, Walsh MW, Gerstein HC, Devereaux PJ. Kidney disease after preeclampsia: a systematic review and meta-analysis. Am J Kidney Dis. 2010;55(6):1026-39.
Fiaschi E, Naccarato R. The histopathology of the kidney in toxaemia. Serial renal biopsies during pregnancy, puerperium and several years postpartum. Light and electron microscopic and immunofluorescent studies. Virchows Archiv A Pathol Anat. 1968;345(4):299-309.
Murakami S, Saitoh M, Kubo T, Koyama T, Kobayashi M. Renal disease in women with severe preeclampsia or gestational proteinuria. Obstet Gynecol. 2000;96(6):945-9.
National Collaborating Centre for Chronic Conditions. Royal College of Physicians; London: 2008. Chronic Kidney Disease: National Clinical Guideline for Early Identification and Management in Adults in Primary and Secondary Care.
Ayansina D, Black C, Hall SJ, Marks A, Miller C, Prescott GJ, et al. Long term effects of gestational hypertension and pre-eclampsia on kidney function: Record linkage study. Pregnancy Hypertens. 2016;6:344-9.
van Balen VAL, Spaan JJ, Cornelis T, Spaanderman MEA. Prevalence of chronic kidney disease after preeclampsia. J Nephrol. 2017;30(3):403-9.
Pollak VE, Nettles JB. The kidney in toxemia of pregnancy: a clinical and pathologic study based on renal biopsies. Medicine (Baltimore). 1960;39:469-526.
Ballermann BJ. Glomerular endothelial cell differentiation. Kidney Int 2005; 67: 1668-71.
Eremina V, Sood M, Haigh J, Nagy A, Lajoie G, Ferrara N, et al. Glomerular-specific alterations of VEGF-A expression lead to distinct congenital and acquired renal diseases. J Clin Invest. 2003;111(5):707-16.
Maynard SE, Min JY, Merchan J, Lim KH, Li J, Mondal S, et al. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003;111(5): 649-58.
Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004;350(7):672-83.
Roberts WG, Palade GE. Increased microvascular permeability and endothelial fenestration induced by vascular endothelial growth factor. J Cell Sci. 1995;1082369-79.
Kaleta T, Stock A, Panayotopoulos D, Vonend O, Niederacher D, Neumann M, et al. Predictors of Impaired Postpartum Renal Function in Women after Preeclampsia: Results of a Prospective Singer Center Study. Dis Markers. 2016;2016:7861919.
Hirashima C, Ohkuchi A, Arai F, Takahashi K, Suzuki H, Watanabe T, et al. Establishing reference values for both total soluble Fms-like tyrosine kinase 1 and free placental growth factor in pregnant women. Hypertens Res. 2005;28(9):727-32.
Cheifetz S, Bellon T, Cales C, Vera S, Bernabeu C, Massague J, et al. Endoglin is a component of the transforming growth factor-beta receptor system in human endothelial cells. J Biol Chem. 1992;267(27): 9027-30.
.Gougos A, St Jacques S, Greaves A, O’Connell PJ, d’Apice AJ, Buhring HJ, et al. Identification of distinct epitopes of endoglin, an RGD-containing glycoprotein of endothelial cells, leukemic cells, and syncytiotrophoblasts. Int Immunol. 1992;4(1):83-92.
Levine RJ, Lam C, Qian C, Yu KF, Maynard SE, Sachs BP, et al.Soluble endoglin and other circulating antiangiogenic factors in preeclampsia. N Engl J Med. 2006;355(10):992-1005.
Elhawary TM, El-Bendary AS, Demerdash H. Maternal serum endoglin as an early marker of pre-eclampsia in high-risk patients. Int J Womens Health. 2012;4:521-5.
Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004;350(7):672-83.
Nachtigal P, Vecerova LZ, Rathouska J, Strasky Z. The role of endoglin in atherosclerosis. Atherosclerosis. 2012;224(1): 4-11.