ไมโครอาร์เอ็นเอในภาวะไตวายเฉียบพลัน
Main Article Content
บทคัดย่อ
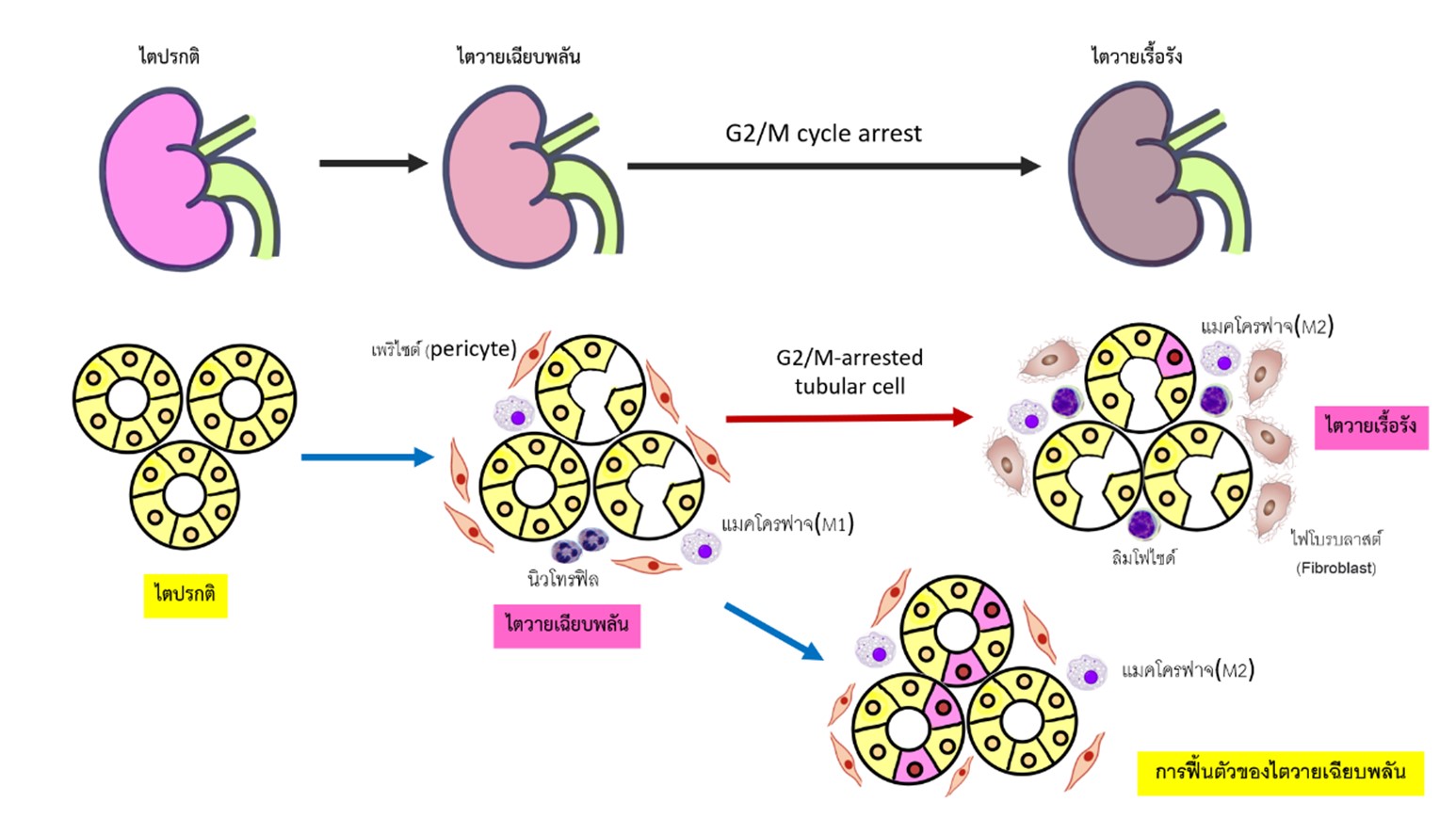
ภาวะไตวายเฉียบพลันเป็นปัญหาที่พบบ่อยซึ่งมีกลไกการเกิดประกอบด้วย การเปลี่ยนแปลงการไหลเวียนโลหิต การตอบสนองของเซลล์ในระบบภูมิคุ้มกัน การอักเสบและอุดตันของเซลล์เยื่อบุท่อไต หลังจากนั้นจะมีการฟื้นตัวของไตโดยเริ่มจากเซลล์เยื่อบุท่อไตส่วนต้นเกิดภาวะสูญเสียการแบ่งตัวและเปลี่ยนแปลงของเซลล์ชั่วคราว ต่อมาเกิดการเพิ่มจำนวนอย่างรวดเร็วและการเปลี่ยนสภาพกลับของเซลล์เยื่อบุท่อไตให้เหมือนเดิม โดยทั่วไปการวินิจฉัยภาวะไตวายเฉียบพลันจะใช้ค่าครีเอตินินในเลือดเป็นเกณฑ์ ต่อมาเริ่มมีการค้นพบตัวชี้วัดทางชีวภาพเพื่อตรวจพบการอักเสบของไตก่อนค่าครีเอตินินในเลือดเพิ่มขึ้นเช่น เอ็นกาว(NGAL) คิมวัน (KIM-1) เป็นต้น แต่เนื่องจากภาวะไตวายเฉียบพลันมีหลายสาเหตุซึ่งการใช้ตัวชี้วัดทางชีวภาพไม่สามารถอธิบายได้หมด จึงเริ่มมีการศึกษาในระดับเซลล์และพบความสัมพันธ์ระหว่างไมโครอาร์เอ็นเอกับภาวะไตวายเฉียบพลันครั้งแรกที่บริเวณท่อไตส่วนต้นของหนูทดลอง โดยไมโครอาร์เอ็นเอ เป็นอาร์เอ็นเอขนาดเล็กที่ไม่ได้ถูกถอดรหัสเป็นโปรตีนแต่มีผลต่อการควบคุมการสร้างโปรตีนที่เพิ่มขึ้นหรือลดลงในเซลล์และนำไปสู่การแสดงออกของยีนที่แตกต่างกัน หลังจากนั้นได้พบไมโครอาร์เอ็นเอหลายชนิดเพิ่มขึ้นซึ่งนำไปสู่การค้นหาในมนุษย์ ไมโครอาร์เอ็นเอ ส่วนมากพบในไซโต พลาสซึมของเซลล์แต่สามารถพบนอกเซลล์ได้เช่น เลือด หรือของเหลวที่หลั่งออกมาจากร่างกายได้แก่ ปัสสาวะ น้ำนม เป็นต้น ซึ่งไมโครอาร์เอ็นเอนอกเซลล์มีลักษณะที่เสถียรและมีการแสดงออกที่แตกต่างกัน ปัจจุบันจึงได้มีการนำเลือดและปัสสาวะมาใช้ตรวจหาไมโครอาร์เอ็นเอ ซึ่งประโยชน์จากการพบความสัมพันธ์ของชนิดไมโครอาร์เอ็นเอในภาวะไตวายเฉียบพลัน สามารถช่วยในการวินิจฉัยการอักเสบของไตก่อนที่ค่าครีเอตินินจะเพิ่มขึ้นและในอนาคตถ้าสามารถยับยั้งหรือกระตุ้นไมโครอาร์เอ็นเอที่เกี่ยวข้องโดยตรงสามารถนำไปสู่การลดอัตราการเกิดไตวายเฉียบพลันหรือลดความรุนแรงของไตวายเฉียบพลันที่จะกลายเป็นโรคไตวายเรื้อรังได้
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความนี้ตีพิมพ์ภายไต้การอนุญาต CC BY-NC-ND 4.0 ซึ่งอนุญาตให้สามารถใช้บทความนี้พื่อวัตถุประสงค์ใดๆ ก็ตามที่ไม่ใช่เชิงพาณิชย์ โดยต้องมีการอ้างถึงที่มาของบทความอย่างครบถ้วน ใครก็ตามสามารถคัดลอกและแจกจ่ายทุกส่วนของบทความนี้โดยไม่ต้องขออนุญาตจากผู้ประพันธ์หรือสมาคมโรคไตแห่งประเทศไทย
เอกสารอ้างอิง
Srisawat N, Kulvichit W, Mahamitra N, Hurst C, Praditpornsilpa K, Lumlertgul N, et al. The epidemiology and characteristics of acute kidney injury in the Southeast Asia intensive care unit: a prospective multicentre study. Nephrol Dial Transplant. 2019.
Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-84.
Ferenbach DA, Bonventre JV. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 2015;11(5):264-76.
Basile DP, Anderson MD, Sutton TA. Pathophysiology of acute kidney injury. Compr Physiol. 2012;2(2):1303-53.
Schena FP, Serino G, Sallustio F. MicroRNAs in kidney diseases: new promising biomarkers for diagnosis and monitoring. Nephrol Dial Transplant. 2014;29(4):755-63.
Brandenburger T, Salgado Somoza A, Devaux Y, Lorenzen JM. Noncoding RNAs in acute kidney injury. Kidney Int.2018; 94(5):870-81.
Wei Q, Bhatt K, He HZ, Mi QS, Haase VH, Dong Z. Targeted deletion of Dicer from proximal tubules protects against renal ischemia-reperfusion injury. J Am Soc Nephrol. 2010; 21(5):756-61.
Lorenzen JM, Kielstein JT, Hafer C, Gupta SK, Kumpers P, Faulhaber-Walter R, et al. Circulating miR-210 predicts survival in critically ill patients with acute kidney injury. Clin J Am Soc Nephrol. 2011;6(7):1540-6.
Lan YF, Chen HH, Lai PF, Cheng CF, Huang YT, Lee YC, et al. MicroRNA-494 reduces ATF3 expression and promotes AKI. J Am Soc Nephrol. 2012;23(12):2012-23.
Du J, Cao X, Zou L, Chen Y, Guo J, Chen Z, et al. MicroRNA-21 and risk of severe acute kidney injury and poor outcomes after adult cardiac surgery. PLoS One. 2013;8(5):e63390.
Ramachandran K, Saikumar J, Bijol V, Koyner JL, Qian J, Betensky RA, et al. Human miRNome profiling identifies microRNAs differentially present in the urine after kidney injury. Clin Chem. 2013;59(12):1742-52.
Aguado-Fraile E, Ramos E, Conde E, Rodriguez M, Martin-Gomez L, Lietor A, et al. A Pilot Study Identifying a Set of microRNAs As Precise Diagnostic Biomarkers of Acute Kidney Injury. PLoS One. 2015;10(6):e0127175.
Gutierrez-Escolano A, Santacruz-Vazquez E, Gomez-Perez F. Dysregulated microRNAs involved in contrast-induced acute kidney injury in rat and human. Ren Fail. 2015;37(9):1498-506.
Saikumar J, Hoffmann D, Kim TM, Gonzalez VR, Zhang Q, Goering PL, et al. Expression, circulation, and excretion profile of microRNA-21, -155, and -18a following acute kidney injury. Toxicol Sci. 2012;129(2):256-67.
Neal CS, Michael MZ, Pimlott LK, Yong TY, Li JY, Gleadle JM. Circulating microRNA expression is reduced in chronic kidney disease. Nephrol Dial Transplant.2011;26(11):3794-802.
Wang N, Zhou Y, Jiang L, Li D, Yang J, Zhang CY, et al. Urinary microRNA-10a and microRNA-30d serve as novel, sensitive and specific biomarkers for kidney injury. PLoS One. 2012;7(12):e51140.
Denby L, Ramdas V, Lu R, Conway BR, Grant JS, Dickinson B, et al. MicroRNA-214 antagonism protects against renal fibrosis. J Am Soc Nephrol. 2014;25(1):65-80.
Gaede L, Liebetrau C, Blumenstein J, Troidl C, Dorr O, Kim WK, et al. Plasma microRNA-21 for the early prediction of acute kidney injury in patients undergoing major cardiac surgery. Nephrol Dial Transplant. 2016;31(5):760-6.
Lorenzen JM, Kaucsar T, Schauerte C, Schmitt R, Rong S, Hubner A, et al. MicroRNA-24 antagonism prevents renal ischemia reperfusion injury. J Am Soc Nephrol. 2014;25(12):2717-29.
Fan PC, Chen CC, Chen YC, Chang YS, Chu PH. MicroRNAs in acute kidney injury. Hum Genomics. 2016;10(1):29.
Aguado-Fraile E, Ramos E, Conde E, Rodriguez M, Liano F, Garcia-Bermejo ML. MicroRNAs in the kidney: novel biomarkers of acute kidney injury. Nefrologia. 2013;33(6):826-34.